Витамин А представляет собой группу жизненно важных микроэлементов, широко присутствующих в рационе человека. Продукты животного происхождения являются богатым источником формы витамина ретинилового эфира, а овощи и фрукты содержат каротиноиды, большинство из которых представляют собой провитамин А. Витамин А играет ключевую роль в правильном функционировании множества физиологических функций. Организм человека может метаболизировать естественные формы витамина А и провитамина А в биологически активные формы (ретинол, ретиналь, ретиноевую кислоту), которые взаимодействуют с множественными молекулярными мишенями, включая ядерные рецепторы, опсин в сетчатке и, согласно последним исследованиям, также некоторые ферменты. В этом обзоре мы стремимся предоставить комплексный взгляд на современные знания о витамине А, начиная от его источников через его физиологические функции и заканчивая последствиями его дефицита и метаболической судьбой, вплоть до возможного фармакологического применения и потенциальной токсичности. Также включены современные аналитические методы, используемые для его обнаружения в реальных образцах.
1. Введение и формы витамина А
Витамин А представляет собой жирорастворимую жизненно важную группу соединений как животного, так и растительного происхождения, характеризующихся ненасыщенной изопреноидной структурой цепи. Все формы витамина А имеют сходную структуру и одинаковые физиологические функции в организме. Эти соединения также могут быть классифицированы как ретиноиды, включая соединения с общей структурой из четырех изопреноидных звеньев природного или синтетического происхождения.(Рисунок 1). Некоторые синтетические производные на первый взгляд не похожи на природные изопреноиды из класса витамина А. Однако в их структурах скрыта основная цепь витамина А, и они похожи на другие ретиноиды по своему взаимодействию с ретиноидными рецепторами. Все эти соединения жирорастворимы и, в отличие от водорастворимых витаминов, легко накапливаются в организме, особенно в печени и жировой ткани. Это представляет, с одной стороны, преимущество, поскольку временное лишение приема витамина А не связано с клиническими симптомами , но, с другой стороны, может появиться накопление с последующей токсичностью.
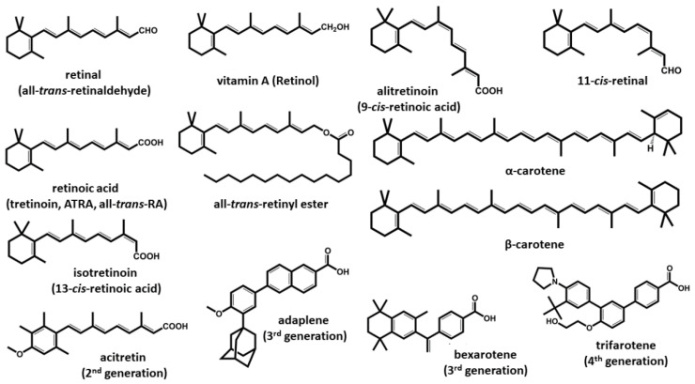
Рисунок 1. Структура витамина А и ретиноидов. Представленные ретиноиды принадлежат к четырем описанным поколениям. Соединения первого поколения встречаются в рационе, за исключением некоторых естественных метаболитов, образующихся в организме. Представители 2-го, 3-го и 4-го поколений представляют собой синтетические производные на основе исходной ретиноевой структуры и применяются при лечении различных заболеваний. Все ретиноиды обладают общей структурой и схожими физико-химическими свойствами, хотя их действие на организм человека может сильно различаться.
Витамин может быть обеспечен в рационе либо через продукты животного происхождения в виде витамина А (ретинол и его близкие производные), либо в виде провитамина А (каротиноиды) из овощей. Хотя термин витамин А чаще всего ассоциируется с ретинолом, а ретинол, по сути, является преобладающей формой ретиноидов в организме человека, основными биологически активными молекулами являются окисленные производные 11-цис-ретиналь и полностью- транс -ретиноидная кислота. АТРА.
Каротиноиды представляют собой органические пигменты от желтого до оранжевого цвета, содержащиеся в некоторых фруктах и овощах. В дополнение к их связи с витамином А, они известны своей антиоксидантной активностью. Некоторыми из наиболее известных каротиноидов являются β-каротин, α-каротин, лютеин, ликопин и криптоксантин. Каротиноиды представляют собой тетратерпеноиды, в отличие от дитерпеноидных ретиноидов животного происхождения, но в конечном итоге могут метаболизироваться до ретинола. Однако не все каротиноиды могут быть преобразованы в витамин А в организме человека. Только те молекулы, которые содержат хотя бы одно незамещенное β-иононовое кольцо, имеют природу провитамина А.
Учитывая плейотропные функции ретиноидов, были разработаны синтетические производные, поэтому ретиноиды можно разделить на четыре поколения. Ретиноиды первого поколения представляют собой формы, встречающиеся в природе: ретинол, ретиналь, ATRA (третиноин), 9-цис - ретиноевая кислота (алитретиноин) и 13- цис -ретиноевая кислота (изотретиноин). Ретиноиды второго поколения были разработаны на основе первого поколения, и членами этой группы являются этретинат и ацитретин. Ретиноиды третьего поколения включают адапален, тазаротен и бексаротен. Трифаротен пока является единственным представителем четвертого поколения ретиноидов и одобрен только в США. Многие из соединений всех трех классов в той или иной степени используются в клинической практике по множеству показаний, которые обсуждаются в соответствующих разделах данного обзора.
2. Источники витамина А
Организм человека не способен вырабатывать витамин А, поэтому его необходимо получать с пищей либо в виде преформированного витамина А, либо в виде каротиноидов провитамина А. Существует более 50 каротиноидов провитамина А, но только β-каротин, α-каротин и β-криптоксантин присутствуют в значительных количествах в рационе человека. Эти каротиноиды были идентифицированы во всех группах фотосинтезирующих организмов, бактерий, грибов и многих животных. β-каротин является наиболее распространенным в рационе. В основном он попадает в организм через красные и оранжевые овощи и частично через фрукты и зеленые овощи того же цвета (Таблица 1). В Европе морковь, шпинат и томатные продукты являются основными источниками потребления β-каротина, в то время как β-криптоксантин чаще всего получают из различных цитрусовых и цитрусовых соков. β-криптоксантин, как и другие каротиноиды, встречается в растениях как в свободном виде, так и в виде эфиров жирных кислот (лауриновой, миристиновой, пальмитиновой), и эти эфиры вносят вклад в общее содержание витамина А благодаря их сопоставимой биодоступности. Богатые источники криптоксантина или его эфиров включают, помимо уже упомянутых цитрусовых (мандарины сацума, мандарины, клементины, минеолы и апельсины), хурму, перец чили и красный перец, папайю, облепиху, мушмулу, манго и абрикосы. Другие источники каротиноидов провитамина А также включают различные лекарственные растения и травы, злаки и определенные растительные масла.(Таблица 1).
Таблица 1. Содержание β-каротина в отдельных источниках.
| Источник | Латинское имя | Семья | Содержание β-каротина |
|---|---|---|---|
| Оранжево-красные овощи | |||
| Сладкая картошка | Ipomoea batatas (L.) Lam. | Вьюнковые | 20–22 600 а |
| Горькая тыква | Момордика харантия L. | тыквенные | 17 040 б |
| Зимний кабачок (баттернат) | Cucurbita moschata Duchesne | тыквенные | 12 340–15 770 а |
| перец чили | Capsicum annuum L., C. chinense Jacq., C. frutescens L. | Пасленовые | 100–15 400 а |
| Морковь | Даукус карота Л. | Зонтичные | 4350–8840 а |
| Тыквы | Cucurbita maxima Duchesne | тыквенные | 70–6070 а |
| Мускусная дыня | Кукумис мело Л. | тыквенные | 2448–3861 а |
| Красный перец | Капсикум однолетний Л. | Пасленовые | 1441–2390 гг . |
| Помидор | Solanum lycopersicum L. | Пасленовые | 59–1500 а |
| Зеленые овощи | |||
| Листья голени | Моринга масличная Лам. | моринговые | 19 700 а |
| Амарант | Амарант гангетический Л. | Амарантовые | 8600 а |
| Кале | Brassica oleracea вар. ацефала ДК. | крестоцветные | 1020–10 000 лет |
| Садовая ракета | Eruca vesicaria (L.) Cav. | крестоцветные | 7960 а |
| Цикорий | Цихориум интибус Л. | Сложноцветные | 3940–7310 а |
| Дикая ракета | Diplotaxis tenuifolia (L.) DC. | крестоцветные | 7010 а |
| одуванчик | Taraxacum officinale (L.) Weber ex FH Wigg. | Сложноцветные | 6340 а |
| Луковый лист | Allium cepa L. | Амариллисовые | 4900 а |
| Кориандр | Кориандр посевной Л. | Зонтичные | 4800 а |
| Петрушка | Petroselinum crispum (Mill.) Fuss | Зонтичные | 4440–4680 а |
| Шпинат | Spinacia oleracea L. | Амарантовые | 3100–4810 а |
| Эндивий | Цихориум эндивия L. | Сложноцветные | 1340–4350 гг. |
| Кресс | Лепидиум посевной Л. | крестоцветные | 2720–3690 гг. |
| лук-порей | Лук ампелопразум Л. | Амариллисовые | 3190 а |
| Латук | Лактука сатива Л. | Сложноцветные | 870–2960 гг. |
| Брокколи | Brassica oleraceae вар. италия Пленк. | крестоцветные | 291–1750 гг. |
| Фрукты | |||
| Абрикос | Прунус секта. Армянка (скоп.) Кох | розоцветные | 585–3800 лет |
| манго | Мангифера индика Л. | Анакардиевые | 109–3210 а |
| Хурма | Диоспирос каки Lf | Эбеновые | 3000 б |
| Даты | Феникс сп. Л. | Арековые | 2950 г. |
| Гуава | Псидиум гуаявский L. | миртовые | 1–2669 а |
| Красный грейпфрут | Цитрусовый рай Макфад. | рутовые | 2580 г. |
| Папайя | Карика папайя Л. | Кариковые | 190–1050 лет |
| Хлопья | |||
| Золотой рис | Ориза сатива Л. | Poaceae | 160–3700 а |
| Кукуруза | Зеа Мэйс Л. | Poaceae | 171–1500 гг . |
| Лекарственные растения и травы | |||
| Шиповника | Роза красная Л. | розоцветные | 3600 а |
| Цветы календулы | Календула лекарственная Л. | Сложноцветные | 940–20 600 а |
| Укроп | Анетум гравеоленс Л. | Зонтичные | 5450 а |
| Бэзил | Базилик базилик обыкновенный L. | Яснотковые | 4820 а |
| Другие | |||
| Спирулина | Спирулина сп. Турпин экс Гомонт | Спирулиновые | 184 100–272 500 человек в год |
| Облепиховое масло | Elaeagnus rhamnoides (L.) А. Нельсон | лоховые | 16 740 с |
| Красное пальмовое масло | Elaeis guineensis Jacq. | Арековые | 5000–5602 в |
a мкг/100 г сырого веса,
b эквивалент CE-β-каротина (мкг/100 г сырого веса) – также включает другие каротиноиды (содержание β-каротина + 1/2 содержания других активных каротиноидов витамина А),
c мкг/100 г масла.
Содержание каротиноидов в отдельных видах растений сильно варьирует в зависимости от многих факторов. Одним из основных показателей может быть цвет мякоти того или иного сорта фрукта или овоща. Четкая связь была показана, например, для сладкого картофеля и тыквы. Существует также сильная корреляция между степенью зрелости и содержанием каротиноидов в фруктах. Наибольшее содержание каротиноидов обнаружено в полностью созревших плодах. Конечно, могут влиять и другие факторы, такие как способ и место выращивания. Все вышеперечисленное относится к свежим фруктам и овощам, но большинство видов обрабатываются или модифицируются различными способами для лучшей усвояемости или хранения. Многие виды фруктов, овощей и трав сушат перед хранением, и было показано, что используемый метод сушки оказывает большое влияние на конечное содержание каротиноидов. До 90 % потерь могут происходить в высушенном на солнце материале, а до 70 % каротиноидов могут сохраняться при сушке в лотковой сушилке при высоких температурах (до 80 °C). Что касается традиционных методов термической обработки, отбеливание и варка сравнимы, сохраняя в среднем 75% каротиноидов, тогда как жарка менее щадящая по содержанию каротиноидов, но все же сохраняет более половины содержания. Джемы – распространенный продукт различных видов переработки фруктов. Потеря β-каротина в этих препаратах сравнима с обычным приготовлением пищи, даже при использовании микроволновой печи.
Биодоступность β-каротина из фруктов и овощей значительно ниже, чем очищенного β-каротина (на один порядок) и значительно различается между видами, что может быть связано с различиями во внутриклеточном расположении каротиноидов. Термическая обработка может повысить биодоступность. Самым старым методом получения чистого β-каротина является его извлечение из растительного сырья. Основными недостатками этого метода являются его высокая цена и сезонность ресурсов. Другой вариант – синтетическое производство. Однако полученные таким образом каротиноиды подвергались сомнению в отношении их безопасности, в связи с чем был разработан ряд методов биотехнологического получения «природного» β-каротина. Многие микроскопические организмы, в том числе дрожжи, плесень, водоросли, цианобактерии и бактерии, могут продуцировать β-каротин и другие каротиноиды. Основным коммерческим источником является водоросль Dunaliella salina (Dunal) Theodoresco. Другим видом, используемым в промышленных масштабах, является плесень Blakeslea trispora Thaxter. β-криптоксантин вырабатывается зелеными водорослями и бактериями. Однако в промышленном производстве он не используется.
Важным источником потребления человеком витамина А является преформированный вариант витамина, который содержится в продуктах животного происхождения. Молоко и молочные продукты, а также мясо и продукты из него вносят наибольший вклад, за ними следуют яйца, яичные продукты и рыба. Количество ретинола, обнаруженного в молоке отдельных видов скота, сильно не различается, хотя некоторое влияние оказывают корма, сезонные колебания и породы. В целом его концентрация колеблется от 20 до 80 мкг на 100 мл цельного молока. Каждая порода производит молоко с разным содержанием жира в зависимости от количества витамина А в молоке. Чем выше содержание жира в молоке, тем выше содержание ретинола. Количество ретинола в молочных продуктах зависит от количества молочного жира в продукте. Одним из богатейших источников витамина А является печень различного скота и птицы, которая содержит десятки миллиграммов ретинола и его эфиров на 100 г. Различия между видами животных значительно более выражены, чем в случае с молоком. Значения, полученные в отдельных исследованиях, значительно различаются, но самое высокое содержание витамина А в печени обычно отмечается у свиней. Количество витамина А в значительной степени зависит от количества β-каротина, содержащегося в кормах или пищевых добавках с преформированным витамином или β-каротином, которые дают животным. Большие различия можно наблюдать, например, у коров, получающих рацион, основанный в основном на зерне, или у коров, питающихся травой. В других органах животных содержание витамина А значительно ниже, а в мясе достигает лишь единиц до десятков микрограммов на 100 г. То же самое верно как для пресноводных, так и для морских рыб. Их печень также содержит единицы до десятков миллиграммов витамина А на 100 г (у некоторых тропических рыб даже до сотен), в то время как их мышцы содержат только десятки микрограммов на 100 г. Как и у других животных, самые высокие уровни витамина А обнаруживаются в печени высших хищников, т. е. плотоядных рыб. Одним из важнейших источников витамина А является масло печени различных морских видов, в том числе акул. Согласно Европейской фармакопее, жир печени трески содержит 18–75 мг витамина А на 100 г масла. Содержание витамина А в различных маслах печени акул достигает сходных значений. Значительное количество витамина также содержится в рыбьих яйцах, где его количество сравнимо с желтками куриных яиц. Желтки куриных яиц могут содержать почти один миллиграмм витамина А на 100 мг. Некоторые источники утверждают, что утиные яйца беднее витамином А, чем куриные, но другие сообщают об обратном. Однако желток перепелиных яиц может содержать в два раза больше, чем куриный. Расхождения в отдельных исследованиях могут быть вызваны многими факторами. Например, существуют значительные различия между отдельными породами кур и программами линьки. Усилия по увеличению количества преформированного витамина А в яйцах с помощью диеты с высоким содержанием каротиноидов (биообогащенная кукуруза, красное пальмовое масло или кожура цитрусовых) не привели к увеличению содержания ретинола в яйцах, несмотря на значительное повышение уровня каротиноидов. Однако содержание каротиноидов провитамина А в яйцах незначительно по сравнению с содержанием преформированного витамина А.
3. Фармакокинетика витамина А
3.1. Всасывание, распределение, метаболизм и выведение
3.1.1. Поглощение
Витамин А в основном получают перорально из пищи. Однако при применении в качестве лекарственного средства возможны дополнительные пути введения, в том числе как внутримышечные, так и местные. Хотя ретиноиды имеют общую структуру, состоящую из гидрофобной области, линкера и полярной области, понятно, что фармакокинетический профиль зависит от каждого способа введения, от физико-химических характеристик каждой формы витамина и используемой лекарственной формы.
Поскольку оральный путь является наиболее частым (фигура 2), этот путь подробно описан. Абсорбция витамина А животного происхождения (ретинола и его производных) и каротиноидов значительно различается. Ретиниловые эфиры, содержащиеся в продуктах животного происхождения, почти полностью всасываются, в то время как всасывание каротиноидов значительно ниже.
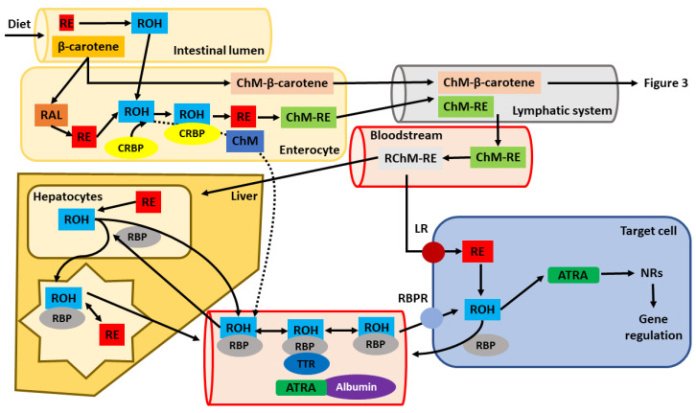
фигура 2. Клеточный путь, поглощение и транспорт перорально принимаемого витамина А. После метаболизма в просвете кишечника, проникновения в энтероциты и его ассоциации с хиломикронами (ХМ), ретиниловые эфиры (РЭ) и β-каротин секретируются в лимфатическую систему. Позже они попадают в кровь (системный кровоток) и впоследствии доставляются в печень, которая функционирует как основной орган хранения ретиноидов в организме или в тканях/клетках-мишенях. Пунктирная линия представляет часть ретинола, который не метаболизируется в клетках кишечника в ретиниловые эфиры и секретируется непосредственно в кровоток, где он может связываться с ретинол-связывающим белком (RBP). Из печени ретиноиды могут секретироваться непосредственно в кровь вместе с RBP или позже связываться с другими транспортными белками (например, альбумином), обнаруженными в крови. Транспорт к тканям-мишеням осуществляется через RBP-рецептор (RBPR). Как только они попадают в клетки-мишени, ретиниловые эфиры или ретинол (ROH) далее окисляются до полностьютранс -ретиноевая кислота (АТРА), отвечающая за генетические функции витамина А в организме (другие сокращения: РАЛ — ретиналь; РХМ-РЭ — ретинальные хиломикроны-ретиниловые эфиры; ТТР — транстиретин; ЛР — липопротеиновый рецептор; НР — ядерные рецепторы; CRBP — клеточный ретинол-связывающий белок).
Поскольку большая часть витамина А животного происхождения принимает форму ретиниловых эфиров, эти эфиры достигают кишечника. Перед попаданием в энтероциты они метаболизируются в ретинол под действием триглицеридлипазы или фосфолипазы В в просвете желудочно-кишечного тракта (фигура 2). Поглощение ретинола может происходить посредством активного транспорта или путем пассивной диффузии. Его всасывание увеличивается при употреблении с жирной пищей, поскольку образование мицелл способствует всасыванию жирорастворимых соединений, таких как витамин А животного происхождения, в тонком кишечнике. В дополнение к жиру для усвоения витамина также необходимы некоторые микроэлементы, такие как цинк. Попав в энтероцит, ретинол связывается со специфическим белком, называемым клеточным ретинол-связывающим белком (CRBP), ответственным за внутриклеточный транспорт ретинола. На сегодняшний день охарактеризованы две изоформы этого белка, CRBPI и CRBPII. Основное различие между ними заключается в их различном выражении внутри тела. В то время как изоформа CRBPI широко экспрессируется, изоформа CRBPII в основном ограничена клетками кишечника, что подчеркивает ее ключевую роль в процессе абсорбции.
Первоначально считалось, что всасывание каротиноидов в кишечнике происходит посредством пассивной диффузии. Однако дальнейшие исследования продемонстрировали участие транспортера рецепторов-мусорщиков класса B1 (SCARB1) и белков кластера дифференцировки 36 (CD36 или SCARB3), хотя все еще считается, что часть каротиноидов может поглощаться путем пассивной диффузии.
Каротиноиды в клетках кишечника могут метаболизироваться в биологически активные формы витамина А или проходить в неизмененном виде (Рисунок 3). Ранние исследования показали, что примерно половина каротиноидов всасывается в неизмененной форме, а остальная часть метаболизируется в ретинол. Однако только около одной трети введенных каротиноидов, в основном β-каротина, может метаболизироваться в эпителии кишечника. Скорость конверсии зависит от разных факторов: их количества, уровня ретинола в организме и жирности рациона. Кроме того, была описана альтернативная процедура расщепления, при которой β-каротин может метаболизироваться в β-апокаротин.(Рисунок 3). Ретиналь, образованный из β-каротина, далее окисляется до ATRA или восстанавливается до ретинола. Этот процесс неспецифичен для энтероцитов. Это также может произойти в печени и других органах. Метаболизм β-каротина тщательно регулируется с помощью механизмов обратной связи, что явно подчеркивает его важность как источника витамина А для человека. При высоком потреблении каротина скорость преобразования мала, и большая часть каротина хранится в жировой ткани и других запасах жира.
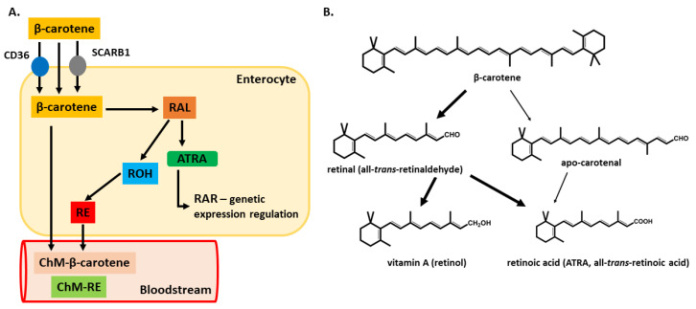
Рисунок 3. Пути метаболизма β-каротина. Абсорбция в просвет кишечника может происходить путем пассивной диффузии или опосредована мембранными белками SCARB1 и CD36. Попадая в цитоплазму энтероцитов, возможны два пути метаболизма. В части A показан наиболее распространенный путь метаболизма y, ведущий в конечном итоге к секреции ретиниловых эфиров (RE) или β-каротина в кровоток, связанных с хиломикронами. Справа (часть Б), проиллюстрированы оба метаболических пути, общий путь и альтернативное расщепление с образованием молекулы апо-каротина. Обе молекулы имеют одинаковый конечный продукт метаболизма (полностью транс-RA, ATRA). Толстые стрелки указывают на наиболее распространенные пути, а тонкие стрелки указывают на менее распространенные пути метаболизма. Сокращения: SCARB1 — рецептор-мусорщик класса B1; РАЛ – сетчатка; ROH–ретинол; CD36 – кластер дифференцировки 36; ХМ-β – каротин-хиломикрон-β-каротин; ХМ-РЭ — хиломикрон-РЭ).
Последующая судьба абсорбированного или образовавшегося ретинола логически одинакова независимо от его происхождения. Он метаболизируется в ретиниловые эфиры, в основном пальмитат, в энтероцитах и секретируется хиломикронами в лимфатическую систему. Попадая в этот комплекс, они не накапливаются в печени. Некоторые сложные эфиры метаболизируются обратно в ретинол, а оставшиеся сложные эфиры далее транспортируются вместе с липопротеинами очень низкой плотности (ЛПОНП) и липопротеинами низкой плотности (ЛПНП). Как уже упоминалось, они могут деэтерифицироваться в ретинол и далее метаболизироваться в активные формы витамина А в различных клетках.
Помимо ретинола и ретиниловых эфиров, другие ретиноиды также могут присутствовать в более низких концентрациях в крови благодаря прямому всасыванию через портальную циркуляцию, такие как ATRA или изотретиноин. ATRA имеет низкую биодоступность после приема внутрь. Он имеет очень высокое сродство к белкам плазмы, поэтому после попадания в кровь транспортируется в комплексе, образующемся с альбумином (фигура 2). Изотретиноин, ретиноид первого поколения, используется только перорально и имеет биодоступность около 20%. Изотретиноин также активно связывается с альбумином в плазме. Концентрация в тканях обычно ниже, чем в плазме. Этретинат и ацитретин, которые являются ретиноидами второго поколения, также используются в терапии перорально. Они имеют биодоступность около 50%.
3.1.2. Распределение и цитоплазматическая судьба витамина А
Хиломикроны, содержащие ретиниловые эфиры, образующиеся в энтероцитах, в конечном итоге попадают в кровоток, откуда могут попасть в ткани-мишени, в основном в печень, являющуюся основным органом хранения витамина А в организме. Однако, прежде чем хиломикроны, нагруженные ретиниловым эфиром, достигнут печени, они подвергаются нескольким ферментативным реакциям, которые приводят к образованию остатков хиломикронов, которые позже поглощаются печенью. Попадая в печень, часть ретиниловых эфиров гидролизуется в ретинол, и в этой форме они связываются с RBP, широко распространенным белком, синтезируемым в гепатоцитах, но который также присутствует в некоторых других тканях, таких как жировая ткань, лейкоциты. легкие, почки, глаза и яички. Образование этого комплекса приводит к его выделению из печени в кровоток и последующему распределению по всему организму. Попадая в кровоток, комплекс ретинол-RBP связывается с другим белком печени, транстиретином (TTR). TTR более известен своей функцией транспорта гормонов щитовидной железы, но, по-видимому, также играет роль в кинетике витамина А. Фактически, его название происходит от «транспортирует тироксин и ретинол». TTR может связываться с RBP перед секрецией в кровеносную систему, образуя стабильный комплекс, необходимый для правильной доставки ретинола к клеткам-мишеням и избегая деградации RBP в почках. Комплекс ретинол-RBP поглощается клетками-мишенями через транспортеры плазмалеммы, которые играют ключевую роль в распознавании переносчиков ретинола в крови и в клеточном поглощении ретинола (фигура 2). Периферические ткани имеют существенную потребность в витамине А. Фактически, почти треть ретиноидов попадает в различные органы (почки, костный мозг, скелетные мышцы, жировую ткань и т. д.). Концентрация комплекса ретинол-RBP достаточно стабильна, за исключением случаев серьезного дефицита витамина А. В этих условиях количество RBP снижается из-за снижения уровня витамина А в организме. Не весь ретинол в гепатоцитах секретируется с RBP. Некоторое количество ретинола транспортируется в звездчатые клетки печени, где он метаболизируется в ретиниловые эфиры и образует основное хранилище витамина А в организме. Как правило, витамин А хранится в виде ретиниловых эфиров. Кроме того, жировая ткань и другие органы могут хранить ретиноиды. Примеры включают яички, надпочечники, легкие, почки и интерстициальные клетки. Эта способность к накоплению важна для органов с высокой потребностью в витамине А, особенно для эпителия сетчатки. В случае диеты с дефицитом витамина А физиологические уровни могут поддерживаться в течение нескольких месяцев благодаря этим сохраненным запасам. При необходимости эти запасающие органы выделяют ретиноиды в кровь. Перед попаданием в кровеносную систему сложные эфиры гидролизуются, и до 95% ретинола связывается с транспортными белками. Интересно, что ацитретин хорошо растворим в воде и, следовательно, не накапливается в жировой ткани.
Циркулирующие ретиноиды обычно связываются с белками крови, особенно с альбумином и, как уже упоминалось, с РСБ. Эти комплексы могут поглощаться клетками-мишенями, например, посредством рецепторов липопротеинов или при стимуляции рецептором ретиноевой кислоты 6 (STRA6).
Ретинол, находящийся в клетках-мишенях, в основном используется для образования ATRA. В этом пути ретинол сначала метаболизируется в ретиналь алкогольдегидрогеназами, а затем связывается с CRBP. На втором этапе дегидрогеназы сетчатки дополнительно окисляют сетчатку до ATRA, который затем связывается с клеточным белком, связывающим ретиноевую кислоту (CRABP). ATRA, кислая форма витамина А, является конечным продуктом окисления витамина А и не может быть восстановлена обратно в ретиналь или ретинол и не может храниться.
3.1.3. Ликвидация
Выведение ретиноидов происходит через почки или через печень в желчь. Эвакуация накопленных ретиноидов, образующихся в организме, происходит медленнее, чем водорастворимых витаминов, поскольку они хранятся в разных органах. После прекращения приема могут пройти месяцы, прежде чем вы заметите какой-либо дефицит витамина А.
3.2. Другие факторы, влияющие на фармакокинетику витамина А
Лекарства и (пато)физиологические состояния могут напрямую влиять на всасывание витамина. Сообщалось, что такие препараты, как эстрогены и оральные контрацептивы, повышают концентрацию RBP в плазме, тем самым повышая уровень ретиноидов в крови. Употребление алкоголя является важным фактором, опосредующим ингибирование метаболизма витамина А. При алкогольной болезни печени концентрация ретинола значительно снижается.
3.3. Фармакокинетика витамина А при беременности
Во время беременности концентрация ретинола в плазме снижается в течение первого триместра и снова медленно увеличивается, снова достигая нормальных значений перед родами. Циркулирующие у матери ретиноиды (ретинол и ретиниловые эфиры) обеспечивают плод витамином А и должны транспортироваться через плацентарный барьер после диссоциации от транспортных белков. Передача РБП от матери к плоду происходит только в I триместре. Позже плод может синтезировать собственный RBP. Хотя считалось, что плацента защищает плод от потребления большого количества витамина А беременными женщинами, получающими избыточное количество витамина А, в нескольких исследованиях сообщалось, что высокое потребление витамина А матерью может привести к тератогенным эффектам на развивающийся плод.
4. Функции витамина А
Витамин А обладает плейотропными функциями в организме благодаря нескольким биологически активным формам. Хотя ретинол, который также отвечает за некоторые процессы, является наиболее распространенной формой в организме, ATRA является основной активной формой витамина А. В меньшей степени биологически активны и другие метаболиты этого витамина, 9- цис -ретиноевая кислота и 13- цис -ретинол. Каждая форма витамина проявляет специфичность в отношении различных тканей и процессов, в которые они вовлечены. Однако они имеют схожие общие свойства. Ретинол действует как кофактор в нескольких ферментативных процессах, 11- цис -ретиналь участвует в зрении, а ATRA выполняет различные функции, связываясь с ядерными рецепторами с последующей регуляцией генетической экспрессии.
Краткое изложение широкого круга физиологических процессов, в которых участвуют ретиноиды, представлено в Рисунок 4. Эти процессы включают зрение в темноте, развитие роговицы и конъюнктивы, рост и дифференцировку клеток, функционирование иммунной системы, развитие костей и плода и формирование центральной нервной системы (ЦНС). Каротиноиды также действуют как антиоксиданты.
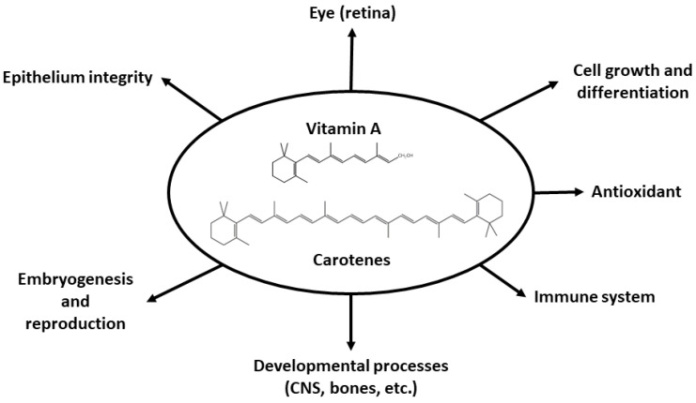
Рисунок 4. Схематическое изображение физиологических ролей, в которых участвует витамин А.
Интересно, что ретиноиды также участвуют в ряде патологических ситуаций: сердечно-сосудистых заболеваниях, сахарном диабете, ожирении, остеопорозе, кожных заболеваниях и раке. Роль витамина А в каждом процессе описана в следующих разделах.
4.1. Зрение
В глазу сетчатка является структурой, отвечающей за зрительное восприятие, включая его передачу в мозг. Это восприятие опосредуется специфическими структурами сетчатки: палочками и колбочками. Палочки чувствительны к слабому освещению и, следовательно, имеют решающее значение для зрения в темноте (например, ночное видение), тогда как колбочки отвечают за свет высокой интенсивности (цветовое зрение). Активным производным витамина А в данном случае является 11- цис -ретиналь. Он связан с белком опсином, белковым рецептором, связанным с G, в сетчатке. Комплекс известен как родопсин, который является важнейшим пигментом для восприятия света. При световых раздражителях 11- цис -ретиналь трансформируется в полностью транс--ретиналя и инициирует цепочку реакций, конечным следствием которых является передача оптических восприятий через зрительный нерв в мозг (Рисунок 5). После этой реакции некоторое количество полностью транс -ретиналя может быть преобразовано обратно в 11- цис -ретиналь, что делает возможной рециркуляцию этой ключевой молекулы. Оставшийся полностью транс -ретиналь может быть преобразован в ретинол, который может храниться в эпителиальных клетках для повторного использования или превращения в ATRA.
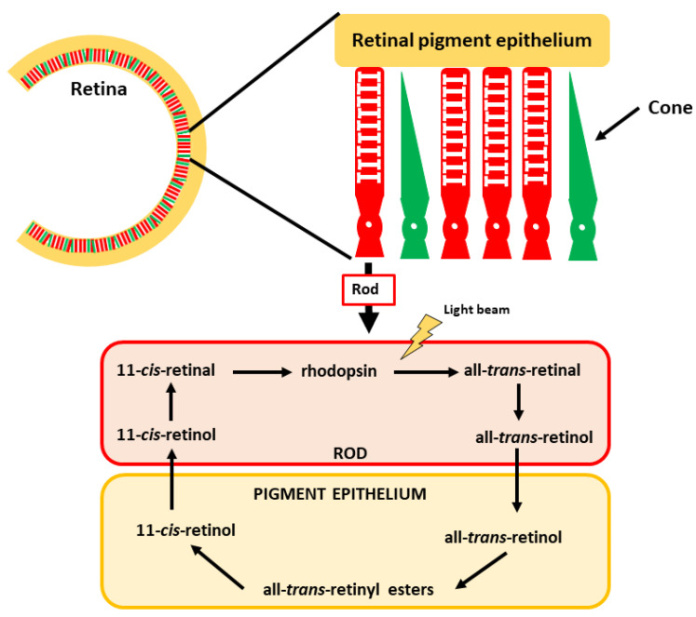
Рисунок 5. Зрение и роль 11- цис -ретиналя в этом процессе. Сетчатка состоит из колбочек и палочек, которые обеспечивают цветовое зрение и зрение при слабом освещении соответственно. Производное витамина А 11- цис -ретиналь находится в палочках, образуя родопсин.
Дефицит ретинола приводит к ухудшению зрения при слабом освещении из-за дефицита образования родопсина. Эта ситуация вызывает куриную слепоту, которую также называют никталопией. Зрение при слабом освещении можно восстановить после нормализации уровня ретинола в плазме. Однако для полного восстановления нормальной функции требуется несколько недель.
4.2. Взаимодействие с ядерными рецепторами
Витамин А является важным фактором регуляции генов. Этот эффект осуществляется за счет взаимодействия с ядерными рецепторами (ЯР). NR представляют собой активируемые лигандом факторы транскрипции, которые при связывании с лигандом могут модулировать экспрессию целевого гена посредством прямого взаимодействия с ДНК. Хотя на сегодняшний день у человека описано 48 семейств NR, все члены имеют общую структуру, состоящую из ДНК-связывающего домена (DBD), лиганд-связывающего домена (LBD) и шарнирной области, которая соединяет обе структуры. LBD обычно представляет собой высокоспецифичную структуру, которая распознает лиганды для каждого типа рецептора. Эти рецепторы могут активироваться как эндогенными молекулами, так и/или ксенобиотиками.
Известно, что ретиноиды взаимодействуют с несколькими семействами ядерных рецепторов. В 1987 году был идентифицирован первый рецептор с высоким сродством к ретиноиду. Он был назван рецептором ретиноевой кислоты α (RARα) из-за его способности связывать ретиноевую кислоту (ATRA) с высоким сродством. Это прорывное открытие объяснило механизмы некоторых биологических функций, связанных с ретиноидами. С тех пор были описаны дополнительные рецепторы, взаимодействующие с ретиноидами. Эти рецепторы обычно называют ретиноидными рецепторами. Основными семействами ретиноидных рецепторов являются RAR и ретиноидный X-рецептор (RXR), но было описано третье семейство NR, взаимодействующее с ретиноидами: RAR-связанный сиротский рецептор (ROR).
После открытия первого члена семейства RAR, RARα (NR1B1), были успешно выделены еще две изоформы RAR, и сообщалось, что они взаимодействуют с производными витамина А: RARβ (NR1B2) и RARγ (NR1B3). RAR прочно связываются с ATRA, а также с 9- цис -ретиноевой кислотой (Рисунок 6). Экспрессия этих рецепторов тканеспецифична. RARα широко распространен в организме, тогда как изоформа RARβ преимущественно присутствует в головном мозге, печени и почках. RARγ сильно экспрессируется в эпидермисе. RAR играют разные роли, как геномные, так и негеномные. В общем, они участвуют в передаче клеточных сигналов. Негеномные процессы опосредованы процессами фосфорилирования и способностью RARα регулировать трансляцию белка.
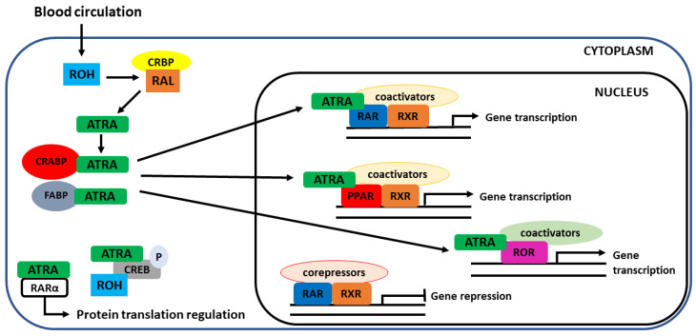
Рисунок 6. Клеточное поглощение клетками-мишенями и внутриклеточными рецепторами витамина А. Попав в цитоплазму, ретинол подвергается нескольким стадиям окисления, которые заканчиваются образованием ATRA, судьба которого внутри клетки может быть разной. ATRA может опосредовать как геномные, так и негеномные функции. Негеномные функции менее известны и включают регуляцию фосфорилирования белков-мишеней (CREB) и регуляцию цитоплазматической трансляции. Геномные функции более распространены и включают связывание ATRA с ядерными рецепторами (RAR, PPAR, RXR, ROR), оказывающими прямое влияние на регуляцию генов. В отсутствие лиганда транскрипция гена подавляется. Чтобы это произошло, ATRA должен транспортироваться в ядро, что опосредовано клеточными белками, связывающими ретиноевую кислоту (CRABP), или белком, связывающим жирные кислоты (FABP). CREB — белок, связывающий элемент ответа цАМФ.
Второе семейство рецепторов с высоким сродством к ретиноидам — это RXR. Этот рецептор представляет собой ключ для функционирования RAR и многих других ядерных рецепторов, поскольку его присутствие необходимо для образования гетеродимеров и, следовательно, механизма транскрипции. Впервые RXR были описаны на несколько лет позже, чем RAR. Подобно RAR, RXR также представлен тремя изоформами с различным распределением в организме (α-NR2B1, β-NR2B2 и γ-NR2B3). В то время как RXRα в основном локализуется в печени, легких и кишечнике, RXRβ повсеместно распространяется по всему телу, а RXRγ преимущественно обнаруживается в мышцах и головном мозге. Эти три изоформы являются важными партнерами по гетеродимеризации для родственных ядерных рецепторов, в основном из подсемейства NR 1. Основное различие между семействами RAR и RXR заключается в структуре LBD, которая определяет специфичность лиганда. ATRA является высокоаффинным лигандом для RAR, но также может активировать RXR. Однако ретиноид с самым высоким сродством к RXR представляет собой 9- цис -ретиноевую кислоту.
Хотя эти два близкородственных семейства рецепторов имеют одни и те же или сходные лиганды и сходные сигнальные пути, они регулируют разные наборы генов.
На молекулярном уровне в отсутствие лигандов РАР находится в клеточном ядре, образуя комплекс с корепрессорами. В таком виде RAR неактивен. При связывании с лигандом комплекс высвобождает ко-репрессоры, опосредуя конформационные изменения, и рекрутируются ко-активаторы. RAR должен гетеродимеризоваться с RXR, чтобы сформировать комплекс транскрипционного аппарата, способствующий транскрипции генов (Рисунок 6). Комплекс гетеродимер-коактиватор-лиганд распознает специфические последовательности ДНК для связывания с промоторной областью генов-мишеней, называемых элементами, реагирующими на ретиноевую кислоту (RARE). RXR может гетеродимеризоваться с большим количеством NR, таких как рецептор прегнана X (PXR), конститутивный андростановый рецептор (CAR) и рецептор витамина D (VDR), среди прочих.
Последними NR, с которыми могут связываться ретиноиды, являются ROR. Как и в семействах RAR и RXR, семейство ROR также представлено тремя изоформами: α, β и γ, и опять же в этом случае их экспрессия тканеспецифична. Следовательно, RORα в основном обнаруживается в печени и головном мозге, β – в сетчатке и головном мозге, а γ – в печени и яичках, среди других тканей. Основное отличие от других описанных ретиноидных рецепторов заключается в том, что они могут регулировать экспрессию генов в мономерах посредством связывания с ROR-чувствительными элементами (RORE) и, следовательно, не нуждаются в димеризации с подобным ретиноидным рецептором RXR. ROR связываются с оксистеролами с высокой специфичностью. Однако также описана конститутивная активация рецептора в отсутствие лиганда. ATRA является ретиноидом с самым высоким сродством к RORβ.
В дополнение к рецепторам, описанным до сих пор, было описано другое семейство рецепторов, которые взаимодействуют с ретиноидами, рецепторы, активируемые пролиферативной активностью пероксисом (PPAR) (Рисунок 6). Это было задокументировано в основном для ATRA. Как и в случае других ретиноидных рецепторов, это семейство рецепторов также представлено тремя изоформами α (NR1C1), β/δ (NR1C2) и γ (NR1C3). Чтобы проявить свою регуляторную активность, эти рецепторы также гетеродимеризуются после связывания лиганда с RXR с образованием транскрипционного комплекса. Высокоспецифичными лигандами для этих рецепторов являются жирные кислоты, и они участвуют в энергетическом гомеостазе, метаболизме жирных кислот и воспалении. Однако только изоформа β/δ проявляет высокое сродство к ATRA. Эта изоформа обильно экспрессируется в коже, головном мозге и жировой ткани. Открытие взаимодействия ATRA с PPARβ/δ объясняет пролиферативный эффект RA на кератиноциты и его участие в чувствительности к инсулину и энергетическом гомеостазе.
Интересно, что ATRA может регулировать его уровни в органах-мишенях посредством катаболических процессов, особенно посредством взаимодействия с ферментами CYP26A1, CYP26B1 и CYP26C1. Роль ATRA во взаимодействии NR является наиболее часто изучаемым механизмом после зрительной роли витамина А. Генетические эффекты, вызванные взаимодействиями между ATRA и его рецепторами, непосредственно вовлечены во многие физиологические функции: клеточная дифференцировка, развитие тканей, регенерация тканей, клеточная апоптоз и др. Кроме того, ATRA выполняет дополнительные функции в регуляции генов, поскольку доказательства показывают, что он выполняет функции регуляции некодирующих РНК.
4.2.1. Витамин А и рак
Роль ретиноидов при раке была в центре внимания многих исследований. Тем не менее, никакие окончательные отношения не были четко установлены. Известно, что ретиноиды способствуют росту клеток и развитию тканей благодаря их взаимодействию с NR. Поэтому некоторые исследования показали, что ретиноиды можно рассматривать как соединения, способствующие развитию рака. Хотя противоопухолевая активность связана с трансрепрессией активирующих белков RAR, предполагается, что ATRA обладает противоопухолевыми эффектами, даже несмотря на то, что он является активатором рецепторов. Исследования in vitro продемонстрировали влияние ретиноидов на апоптотические гены и потенциальный защитный эффект витамина А против некоторых видов рака. Эта информация следует за исследованием, в котором сообщалось о дефиците витамина А как о факторе развития рака. Кроме того, предполагается, что ретинол также участвует в регуляции роста клеток. ATRA, используемый при лечении острого промиелоцитарного лейкоза, способствует дифференцировке клеток за счет активации факторов транскрипции. Однако он также ингибирует набор белков, участвующих в развитии клеток, и активирует клеточный апоптоз. В дополнение к его дифференцирующему эффекту, также сообщалось, что он ингибирует пролиферацию лимфомы и опухолей легких, печени и солидных опухолей яичников. Важно отметить, что в дополнение к третиноину и алитретиноину ретиноиды другого поколения уже используются в клинической практике в качестве антипролиферативных средств.
Роль каротиноидов в раке еще более противоречива, особенно в случае β-каротина. Несмотря на то, что это хорошо известный антиоксидант с потенциально положительным эффектом при сердечно-сосудистых заболеваниях и сахарном диабете II типа, в нескольких исследованиях сообщалось о противоречивом влиянии каротиноидов на заболеваемость раком. В различных исследованиях наблюдалась более низкая заболеваемость эпителиальным раком и раком легких у лиц с высоким потреблением каротиноидов из рациона, богатого фруктами и овощами. Однако в некоторых исследованиях сообщалось, что в когорте курильщиков после введения β-каротина наблюдалась более высокая заболеваемость раком легких и смертность по сравнению с контрольной группой. Важно отметить, что эти эффекты наблюдались при добавлении бета-каротина, а не при более низком потреблении каротиноидов с пищей. Напротив, в нескольких клинических и доклинических исследованиях сообщалось, что каротиноиды предотвращают образование активных форм кислорода (АФК), вызывают апоптоз в опухолевых клетках и предотвращают индукцию рака.
4.2.2. Витамин А, иммунитет и воспаление
Адаптивная иммунная система — еще один процесс, в котором витамин А играет ключевую роль. Витамин действует как кофактор пролиферации и дифференцировки регуляторных Т-клеток и некоторых иммунных функций через непрямые процессы. В присутствии витамина А уровни ИЛ-2 повышаются, что стимулирует дифференцировку Т-клеток в регуляторные Т-клетки, которые являются важными медиаторами для предотвращения аутоиммунных реакций. Регуляторные Т-клетки могут модулировать образование трансформирующего фактора роста-β (TGF-β), ключевого комплекса иммунных и воспалительных реакций, экспрессия которого может модифицироваться RA. Без этой взаимосвязи единственное присутствие TGF-β могло бы способствовать аутоиммунному ответу. Несмотря на уже описанную роль ATRA в иммунной системе, сообщалось о противоречивой роли ретиноидов в отношении их роли в ингибировании или усилении воспалительных реакций. Важно отметить, что лимфоциты имеют на своей поверхности ретиноидные рецепторы, которые распознают ATRA и ретинол. Роль ретиноидов, по-видимому, связана не только с ретиноидными рецепторами, поскольку ретинол, а не ATRA, действует как кофактор роста В-лимфоцитов и активации Т-лимфоцитов. Эффекты опосредуются, в частности, его метаболитом 14-гидрокси-4,14-ретро-ретинолом (14-HRR). Кроме того, сообщалось, что 14-HRR оказывает сходное стимулирующее действие на рост фибробластов и промиелоцитов. Помимо дифференцировки Т-клеток, витамин А также важен для регуляции покоя гемопоэтических стволовых клеток и других медиаторов воспаления. В состояниях дефицита популяция гемопоэтических стволовых клеток уменьшается, поскольку они не могут оставаться в состоянии покоя, что приводит к дисбалансу в иммунной системе. Реакция иммунной системы на инфекции, такие как корь и паразитарные инфекции, снижается при дефиците витамина А, а тяжесть и продолжительность этих состояний увеличиваются, если уровень витамина А не восстанавливается быстро.
4.2.3. Другие функции, связанные с транскрипцией генов
Витамин А также участвует в синтезе муцина бокаловидными клетками кишечника. Раннее исследование, проведенное на цыплятах, показало, что скорость замены бокалов и, следовательно, образование муцина снижается при дефиците витамина А. Особенно этот процесс наблюдается в эпителии ЖКТ. Общеизвестной функцией витамина А является поддержание функциональной и структурной целостности эпителия в различных тканях. Ретиноиды участвуют в поддержании нормального эпителиального гомеостаза, способствуя дифференцировке кератиноцитов в зрелые эпидермальные клетки. При адекватном уровне витамина А базальные эпителиальные клетки в секретирующих слизь или ороговевающих тканях стимулируются и вырабатывают слизь. Отклонения в гомеостазе ретиноидов оказывают прямое влияние на целостность кожи. В условиях избыточных концентраций ретиноидов образуется толстый слой муцина, ингибирующий кератинизацию, что приводит к вредным эффектам. С другой стороны, при дефиците витамина А секреция слизи подавляется и вызывает расслоение и ороговение эпителия, что приводит к раздражению и последующему инфицированию. При этом дефиците поражаются кожа, потовые железы, глаза, трахея, бронхи, слюнные железы и мочеполовой тракт. Эти эффекты витамина А, проявляющиеся на эпидермальном уровне, опосредованы взаимодействием ATRA с NR, главным образом RAR и RXR, которые экспрессируются в кератиноцитах, волосяных фолликулах и дермальных фибробластах.
Эмбриогенез — еще один процесс, в котором присутствие ретиноидов имеет решающее значение для правильного роста и развития. Во время беременности матери необходимо обеспечить плод витамином А. Дефицит витамина А в этот период приводит к эмбриональным порокам развития, известным под общим названием синдром дефицита витамина А, который проявляется, среди прочего, дефицитом сердечно-сосудистой и нервной систем и менее развитыми тканями.
После рождения новорожденные обычно рождаются с низким уровнем витамина А, хотя у их матерей он обычно находится в рекомендуемых пределах. Эти уровни корректируются с помощью грудного вскармливания, поскольку грудное молоко является богатым источником витамина А. Потребность в витамине А у кормящих женщин логично возрастает. Основным ретиноидом, обнаруженным в грудном молоке, является ATRA, поскольку он немного лучше растворяется в воде, чем другие ретиноиды.
В поврежденных тканях ретиноиды способствуют обновлению эпидермиса и восстановлению нормальной ткани. ATRA опосредует эти функции, стимулируя синтез коллагена и фибронектина и пролиферацию кератиноцитов, способствуя быстрому восстановлению нормального эпидермиса. При дефиците ретиноидов нарушается нормальное восстановление эпителия, и для протекания процесса требуется более длительное время.
Через активацию NR ретиноиды участвуют в метаболизме липидов и чувствительности к инсулину. Активация RAR и PPAR регулирует гены, которые непосредственно вовлечены в транспорт глюкозы, окисление жирных кислот, липолиз и дифференцировку адипоцитов. Повышенные уровни RBP в крови связаны с резистентностью к инсулину. Напротив, сообщалось, что ретиналь улучшает метаболический синдром, предотвращая образование жировой ткани, что играет непосредственную роль в ожирении. Снижение уровня витамина А недавно было связано со смертностью среди пожилых людей. У людей с ожирением жировая ткань широко распространена по всему телу, что ставит под угрозу правильное функционирование множества физиологических процессов, поскольку эта ткань является богатым источником цитокинов, гормонов и факторов роста. Недавнее исследование связывает более высокий уровень ретиноидов в плазме с более низким риском сердечно-сосудистых заболеваний у пациентов с сахарным диабетом II типа. Кроме того, считается, что потребление каротиноидов помогает предотвратить ожирение. Однако необходимы дальнейшие исследования по этой теме. Дополнительными процессами, в которых, как сообщается, участвует витамин А, являются липидный обмен, реакция на инсулин и энергетический гомеостаз.
Вход в мейоз — еще один процесс, в котором участвуют ретиноиды посредством их взаимодействия с NR, особенно с RAR. Этот процесс, который включает в себя переход между митозом и мейозом, важен для дифференцировки гонад в развитии плода и в сперматогенезе у взрослых мужчин. Сообщалось, что ATRA является пусковым фактором в процессе входа в мейоз у животных и людей. Это является следствием функции ATRA в процессах дифференцировки клеток. Однако этот процесс весьма специфичен среди видов. Изменения в уровнях факторов, участвующих в этом процессе, или в сроках наступления приводят к последствиям, которые могут быть достаточно серьезными для здоровья человека, например, нарушениям полового развития, бесплодию или даже формированию рака.
4.3. Другие функции ретиноидов
В этом разделе кратко описаны другие физиологические или фармакологические действия, которые, по-видимому, не связаны с их взаимодействием с ретиноидными рецепторами.
Поскольку уровни витамина А, циркулирующего в организме, выше, чем количество витамина, необходимого для зрения и уже описанных генетических функций, можно предположить, что ретиноиды могут участвовать в дополнительных биологических процессах. Во второй половине прошлого века при дефиците витамина А наблюдалось снижение активности ряда ферментов, что свидетельствует о том, что ретиноиды могут выступать в качестве кофакторов в некоторых ферментативных реакциях. Эта негеномная активность ретиноидов объясняет многие из их действий, например, эффекты, наблюдаемые на дерматологическом уровне. Негеномные эффекты могут быть опосредованы фосфорилированием белка, которое продолжается при активации генома.
Витамин А участвует в восстановительно-окислительном гомеостазе. Первой описанной формой ретиноидов, действующей таким образом, был ретинол, который, как сообщалось, связывался с различными белками из семейства серин/треонинкиназ, особенно с быстро ускоренной фибросаркомой (Raf) и протеинкиназой C (PKC), и функционировал как окислительно-восстановительный реагент. Известно, что помимо ретинола ATRA регулирует активность этих ферментов, участвующих в пролиферации и дифференцировке. Каротиноиды, как сообщалось выше, являются хорошо известными антиоксидантами. Однако исследования показали, что в избытке каротиноиды могут также оказывать прооксидантное действие.
Возрастная макулярная дегенерация является частой причиной слепоты у пожилых людей. Это состояние связано с окислительным стрессом. Поэтому соединения с антиоксидантными свойствами, такие как каротиноиды, были протестированы при лечении этого заболевания. Недавние исследования показали, что потребление каротиноидов лютеина и зеаксантина, но не β-каротина, показало более низкий риск развития этого заболевания. Поскольку β-каротин не участвует, этот эффект, вероятно, не основан на витамине А. Кроме того, сообщалось, что каротиноиды потенциально способны улучшать диабетическую ретинопатию.
Другим процессом, в котором участвует витамин А, или, точнее, ATRA, является негеномная быстрая синаптическая передача (166). Сообщалось также, что ATRA ингибирует активацию Са-АТФазы, опосредованную энуклеацией эритроцитов тироксином (Т4) и 3,3',5-L-трийодтиронином (Т3). Также сообщалось, что ретиноиды активны на уровне ЦНС. Предполагается, что ATRA участвует в процессах развития памяти и обучения. Эта роль подтверждается дефектами, наблюдаемыми при структурных аномалиях ЦНС и нарушении развития в ситуациях отсутствия ATRA. Интересно, что недавнее исследование связывает потенциально положительное использование ретиноидов при болезни Альцгеймера, вероятно, посредством регуляции клеточной дифференцировки.
Также было показано, что ATRA обладает дополнительными внеядерными функциями, такими как активация киназы (например, MAPK). Предполагается, что альтернативный механизм действия ретиноидов осуществляется посредством взаимодействия с белками посредством ковалентных связей. Исследования показали, что, хотя небольшое количество белков может действовать таким образом, некоторые из них очень важны для физиологических процессов, в которых участвуют важные ферменты, такие как цАМФ-киназа и рибонуклеотидредуктазы, и это лишь некоторые из них.
Ретиноиды также играют роль в гомеостазе костей. Было описано, что повышенный уровень ретиноидов оказывает нежелательное воздействие на кости экспериментальных животных, способствуя их хрупкости и истончению. Однако снижение уровня витамина А также оказывает пагубное влияние на метаболизм костей. С другой стороны, каротиноиды способствуют правильному формированию костей благодаря своим антиоксидантным свойствам. Однако такие эффекты не связаны с физиологической функцией витамина А. Кроме того, перекрестные помехи между витаминами были описаны в отношении костного метаболизма, что понятно, в основном среди жирорастворимых витаминов A, D, E и K. Несколько примеров подтверждают этот вывод, например, (1) витамин А, как сообщается, предотвращает абсорбция витаминов D и E в моделях, (2). Хотя хорошо известно, что снижение уровня витамина D способствует хрупкости костей, сообщалось, что этот эффект усугубляется у людей, которые также потребляют большое количество витамина А. опосредование реакции витамина D-кальция, (3). Было предложено, чтобы высокое потребление витамина А уменьшало токсичность витамина D и токсическое воздействие на метаболизм костей, (4). Кроме того, дефицит витамина D и высокая концентрация витамина А в крови связаны с хрупкостью костей, (5). Также предполагается потенциальный синергетический эффект между обоими витаминами, вызывающими апоптоз в раковых клетках и предотвращающий развитие рака легких. Следовательно, уровни витамина А в организме могут иметь последствия в отношении метаболизма других витаминов или эффектов, вызываемых ими.
5. Аналитические подходы к измерению уровня витамина А
В настоящее время доступно несколько аналитических инструментальных методологий с необходимой чувствительностью, специфичностью и/или разрешением для количественного определения эндогенных ретиноидов и родственных соединений в тканях и биологических жидкостях (Таблица 2). Анализ ретиноидов должен учитывать важные требования, которые необходимо учитывать для обеспечения надежных качественно-количественных результатов. Фактически, чтобы иметь достаточную чувствительность и специфичность для обнаружения аналитов в физиологических условиях и тщательно проверенных протоколах, для количественного определения ретиноидов в биологических образцах требуются методы разделения, способные разделять эндогенные изомеры.
Таблица 2. Краткое изложение методов определения ретиноидов и каротиноидов в биологических материалах человека.
| Техника | Чувствительность (нмоль/л) | Матрица | Аналиты | Преимущества | Недостатки |
|---|---|---|---|---|---|
| ВЭЖХ-УФ-визит/ДАД | 1 0,1 × 10–3 –209,46 | Сыворотка, плазма, семенная плазма, эмбрионы и почки мышей, высушенные пятна цельной крови, грудное молоко, эритроциты, жировая ткань | Ретиноиды (ретинол, ретиналь, РА, ретиниловые эфиры) и каротиноиды |
Обычно небольшой объем пробы (30–200 мкл) Комбинация с автоматизацией и онлайн-подготовкой проб Короткое время анализа в некоторых многокомпонентных анализах Некоторые методы имеют сравнимую чувствительность к МС-детектированию |
Длительное время анализа со сложным градиентом Использование большого объема токсичных растворителей в качестве подвижной фазы и в процедурах пробоподготовки, в основном при анализе каротиноидов |
| ВЭЖХ-FLD | 1 2,3–34,91 | Плазма, грудное молоко | ретинол |
Не часто используется Нет достаточных данных |
|
|
ЖХ-МС ЖХ-МС/МС |
2 2 × 10 −6 –261,83 | Моча, плазма, амниотическая жидкость, слезы, сыворотка | Ретинол, РА | Обычно простые процедуры пробоподготовки | В случае ретиноевой кислоты использование больших объемов токсичных растворителей в процедурах пробоподготовки с плохим извлечением |
| SFC-МС/МС | 1 0,09 × 10–6 –70,31 | Цельная кровь, плазма, сыворотка, молозиво | Каротиноиды, апокаротиноиды, эпоксикаротиноиды |
Небольшой объем образца (10–200 мкл) Короткое время анализа при многокомпонентном анализе Комбинация с онлайн-SFE или роботизированным SLE |
|
| ВЭЖХ-ЭЗД | 1 0,4 × 10–3 –314,19 | Сыворотка, крысиная плазма, ткань шейки матки | Ретинол, РА, каротиноиды |
Небольшой объем образца (20–200 мкл), малое время анализа при многокомпонентном анализе ретинола и РА |
Длительное время анализа каротиноидов Использование токсичных растворителей |
| наборы ИФА | 1 0,11–279,38 | Цельная кровь, сыворотка, клеточные лизаты, плазма, ткани, другие жидкости человека, молозиво | Ретинол, β-каротин | Один комплект для различных матриц (сыворотка, плазма, другие биожидкости, клеточные лизаты) |
Только для исследований Перекрестная реактивность с аналогами ретинола Требует времени и денег для небольших серий образцов |
| Наборы для ВЭЖХ/УВЭЖХ-УФ | 2 23,62–1174,5 | Плазма, сыворотка | Ретинол, каротиноиды |
Небольшой объем образца (50–250 мкл) Некоторые наборы: можно комбинировать с форматом 96-луночных планшетов 96 образцов за 30 мин. Некоторые наборы: доступны в режиме УВЭЖХ – 3 аналита за 3,5 мин. |
Некоторые наборы имеют длительное время анализа и используют большие объемы образцов (400 мкл). Только для сыворотки или плазмы. |
1 LOD — предел обнаружения, 2 LLOQ — нижний предел количественного определения. DAD – обнаружение диодной матрицы; ЭХД – электрохимическое детектирование; ИФА твердофазный иммуноферментный анализ; FLD – детекция флуоресценции; ВЭЖХ – высокоэффективная жидкостная хроматография; ЖХ–МС – совмещение жидкостной хроматографии и масс-спектрометрии; РК – ретиноевая кислота; SFC-MS – сочетание сверхкритической флюидной хроматографии и масс-спектрометрии; СФЭ – сверхкритическая флюидная экстракция; SLE – жидкостно-жидкостная экстракция на твердом носителе; УВЭЖХ – сверхвысокоэффективная жидкостная хроматография; UV-vis — обнаружение в ультрафиолетовом/видимом диапазоне.
Методы анализа ретиноидов, описанные в литературе, включают (ультра) высокоэффективную жидкостную хроматографию ((U)HPLC) в сочетании со спектрофотометрическим (UV-Vis/DAD), спектрофлуориметрическим (FLD), электрохимическим (ECD) детектированием, масс-спектрометрией (MS и МС/МС), а также сверхкритическую флюидную хроматографию (СФХ) и на основе иммуноанализа, отличающиеся различной чувствительностью, эффективностью по отношению к разным биологическим матрицам, преимуществами и ограничениями. Сравнение этих методологий представлено в Таблица 2.
5.1. Средства обнаружения
Методологии ВЭЖХ в сочетании с УФ-видимым/ФДА-детектированием обычно осуществимы и экономически эффективны, но обеспечивают средне-низкую чувствительность и не позволяют проводить массовую идентификацию. Однако недавние достижения в технологии хроматографических колонок позволили, по крайней мере, частично снизить пределы обнаружения. УФ-излучение после разделения ретиноидов с помощью ВЭЖХ в некоторой степени обеспечивает специфичность анализа, поскольку немногие соединения поглощают волны, характерные для ретиноидов. Кроме того, УФ-обнаружение ретиноидов показывает определенную степень структурно-зависимых максимумов поглощения, что потенциально может предоставить дополнительную информацию. Преимущества УФ также включают простоту и экономичность, особенно по сравнению с методами обнаружения на основе МС. В то время как одна длина волны и DAD эффективны для анализа ретиноидов in vitro и количественного определения распространенных эндогенных ретиноидов (ретиналь, ретинол, сложные эфиры ретиноидов) in vivo, они обычно не обладают необходимой чувствительностью для проведения эндогенного биоанализа ретиноевой кислоты. Фактически, концентрации эндогенного ATRA в тканях на несколько порядков ниже предела обнаружения и/или предела количественного определения как для DAD, так и для одноволнового обнаружения.
Детекторы на основе флуоресцентной спектроскопии обладают большей специфичностью, чем спектрофотометрические (из-за выбора длин волн как возбуждения, так и испускания) для анализа ретинола и его аналогов в биологических образцах. Ретинол и ретиниловые эфиры интенсивно флуоресцируют, но ретиналь и ретиноевая кислота вместе с большинством синтетических ретиноидов не флуоресцируют. С другой стороны, что касается каротиноидов, то лишь немногие из них проявляют сколько-нибудь заметную флуоресценцию. По этой причине аналитические платформы в сочетании с обнаружением флуоресценции не используются интенсивно для выполнения рутинных анализов ретиноидов и каротиноидов.
Методы ВЭЖХ в сочетании с ЭЗД обладают повышенной чувствительностью, но не имеют четкой идентификации по массе аналитов МС. На них могут влиять помехи от матричных соединений и других аналитов, а на их чувствительность сильно влияют растворители, тип электрода и характеристики потока.
ГХ-МС обеспечивает хорошую чувствительность, но требует дополнительных этапов дериватизации для проведения анализа ретиноидной кислоты, что часто представляет собой трудоемкие процедуры и потенциальный источник ошибок. Одноквадрупольные анализы на основе ЖХ-МС обеспечивают массовую идентификацию аналитов, но не обладают повышенной чувствительностью и специфичностью режимов мониторинга выбранных реакций (SRM) или мониторинга множественных реакций (MRM), обеспечиваемых тройным квадрупольным детектированием МС/МС. Тройной квадруполь ЖХ-МС/МС обеспечивает наиболее эффективный качественно-количественный анализ ретиноевой кислоты с достаточной чувствительностью и специфичностью, но не требует дериватизации или идентификации определенной массы. Низкое количество эндогенных ATRA требует чувствительного обнаружения. МС/МС в настоящее время является наиболее чувствительным методом, используемым для проведения биоанализа ретиноевой кислоты, и его легко сочетать с разделением ЖХ, позволяющим разделять изомеры ретиноевой кислоты. МС/МС обеспечивает соответствующую чувствительность для обнаружения благодаря уменьшению фона в 100–1000 раз по сравнению с МС. МС/МС также обеспечивает повышенную селективность, требуя, чтобы аналиты соответствовали как исходному иону, так и иону продукта.m/z условия обнаружения. Преимущество МС/МС в чувствительности и уменьшении фона позволяет проводить анализ небольших количеств тканей и биологических образцов с более надежными качественно-количественными данными. Информация, полученная при фрагментации MS/MS, может также идентифицировать неизвестные молекулы.
5.2. Хроматографические соображения
Поскольку изомеры ретиноевой кислоты являются изобарными и имеют перекрывающиеся УФ-спектральные профили, одноквадрупольная масса и/или УФ-детектирование с одной длиной волны не могут различать геометрические изомеры, которые могут совместно элюироваться. Несколько инструментальных методологий позволяют разделить эндогенные изомеры ретиноевой кислоты. Методы разделения таких изомеров включают как нормально-фазовые, так и обращенно-фазовые подходы к разделению, причем обращенно-фазовое разделение стало преобладающим из-за его более подходящего сочетания с МС/МС. Методы, основанные на обращенно-фазовом разделении эндогенных изомеров ретиноевой кислоты, в основном включают использование стационарных фаз С18 или связанных стационарных фаз с внедренными полярными группами. Например,
Инструментальные методологии SFC используют CO 2 в его сверхкритическом состоянии в качестве основного элюирующего растворителя. Затем сила элюирования регулируется добавлением небольших количеств модификаторов, которыми в большинстве случаев является спирт или, в меньшей степени, буферы или кислоты/основания, чтобы расширить диапазон полярности образца, который можно анализировать. По сравнению с обращенно- и нормально-фазовыми растворителями CO 2 негорюч, дешев, смешивается с обычными органическими растворителями и меньше загрязняет окружающую среду. Это основная причина, по которой SFC можно считать методом «зеленой» хроматографии. Что касается производительности системы, сверхкритический CO 2 имеет низкую вязкость и высокую диффузионную способность, что приводит к сокращению времени уравновешивания и анализа. Наконец, СО 2прозрачен для излучения выше 190 нм, что позволяет обнаруживать УФ и флуоресценцию. Одним из основных ограничений SFC является растворимость образца, так как высокополярные соединения, такие как ионные, трудно анализировать.
5.3. Другие методы
Помимо инструментальных аналитических методологий, упомянутых выше, были также разработаны дополнительные методы, основанные на иммунологических анализах, для оценки ретиноидов и каротиноидов. Иммуноферментные анализы (ELISA) являются наиболее широко используемыми иммуноферментными анализами из-за их высокой пропускной способности. Эти методы позволяют резко сократить количество анализов, необходимых для обнаружения витаминов в различных образцах. Такие методы, как правило, оправданы при необходимости проведения рутинного контроля качества образцов достаточно простых составов. К достоинствам этих методов можно отнести простоту использования, компактность и относительно низкую стоимость анализа. Иммуноанализы готовы к использованию и экономически эффективны для высокопроизводительных анализов, что делает их особенно полезными для рутинного использования. С другой стороны, им может не хватать достаточной специфичности.
5.4. Соображения относительно стабильности ретиноевой кислоты
Ретиноевая кислота подвержена деградации даже при хранении в условиях контролируемой температуры. Таким образом, необходимо принять тщательные меры предосторожности для обеспечения высококачественных протоколов обработки образцов перед проведением инструментальных анализов, поскольку это может привести к искусственным изменениям уровней эндогенных ретиноидов. Более распространенные эндогенные ретиноиды, такие как ретинол и ретиниловые эфиры, менее подвержены деградации, вызванной хранением.
В качестве общих соображений при анализе ретиноевой кислоты в тканях и биологических жидкостях образцы следует хранить в замороженном виде до гомогенизации (образцы не следует хранить в виде гомогенатов в течение длительного времени). В то же время рекомендуется использовать процедуры быстрого замораживания (например, с использованием жидкого азота), максимально защищая образцы от воздействия света в течение всего времени обработки и хранения. Выполнение анализов в течение нескольких дней после забора ткани или биологической жидкости предпочтительнее, но можно отложить его на срок до 1–2 недель без каких-либо значительных ухудшений. Большинство образцов, хранящихся в течение периода, превышающего 1 месяц, могут показать измеримую потерю, особенно для ретиноевой кислоты. Предварительные анализы стабильности анализируемого вещества в зависимости от матрицы целесообразны, если хранение проводится до проведения анализа. Окончательно,
6. Дефицит витамина А
Рекомендации по потреблению витамина А варьируются в зависимости от возраста людей и обычно выражаются в виде эквивалента активности ретинола (RAE), где один RAE равен 1 мкг ретинола, 12 мкг β-каротина и 24 мкг α-каротина или β-каротина. криптоксантин. Для детей и младенцев рекомендуемое потребление витамина А колеблется в пределах 400–500 RAE. Для взрослых мужчин рекомендуемая суточная доза составляет 900 RAE, в то время как для женщин, беременных и кормящих женщин рекомендуемые уровни варьируются от 700 до 1300 RAE, причем самый высокий уровень приходится на кормящих женщин. Как уже упоминалось, достаточный уровень витамина А является ключевым фактором для правильного развития плода, а затем и для правильного питания новорожденного.
6.1. Симптомы
Наиболее характерным последствием дефицита витамина А является нарушение зрения. Раннее ухудшение зрения является значительным, особенно в условиях недостаточного освещения. В крайних случаях из-за длительного дефицита витамина А эпителий конъюнктивы и роговицы теряет свою способность к дифференцировке, что приводит к гиперкератинизации эпителиальной ткани глаза (ксерофтальмии) и, в конечном итоге, к полной слепоте, которая может быть постоянной. Это обстоятельство является наиболее частой причиной слепоты в развивающихся странах.
Модификации эпителия из-за дефицита витамина А напрямую влияют на несколько систем в организме человека и вызывают потерю веса. В дыхательной системе происходят изменения бронхореспираторного эпителия, и ткань становится более подверженной инфекциям. Кожа может кератинизироваться, а эпидермис высыхать с последующим появлением папулезных высыпаний и ороговением потовых желез. Эпителиальные модификации встречаются и в мочеполовой системе. На уровне репродуктивной системы нарушается сперматогенез, может наблюдаться дегенерация яичек. В желудочно-кишечном тракте отмечается уменьшение количества бокаловидных клеток в кишечнике, альтерация эпителия, метаплазия эпителия протоков поджелудочной железы. Сообщалось также о поражении нервов, а ороговение этой ткани приводит к потере чувствительности. В дополнение к более высокой частоте инфекций дыхательных путей из-за повреждения эпителия, другими симптомами дефицита витамина А являются общая восприимчивость к инфекции и воспалению. Этому явлению способствует недоедание. Во время воспаления потребности в питательных веществах повышаются, а иммунитет снижается. В дополнение к низкому содержанию витамина А у детей, страдающих от недоедания, также обнаруживают сниженный уровень транспортных белков крови, что еще больше ухудшает фармакокинетику витамина А и последующую функциональность. Также известно, что витамин А влияет на метаболизм железа. Его дефицит оказывает прямое влияние на уровень железа через метаболизм и нарушение синтеза гема. Это особенно важно для детей и беременных женщин. Таким образом, дефицит витамина А может вызвать анемию. Роль витамина А в канцерогенезе описана в разделе 4.2.1.
6.2. Причины и эпидемиология
Недостаточный уровень витамина А диагностируется, когда уровень ретинола в плазме снижается ниже 0,52 мкМ или концентрация в печени ниже 5–20 мкг/г. Их можно классифицировать как первичные или вторичные дефициты в зависимости от причины. Недостаточное потребление витамина А и каротиноидов с пищей является основной причиной дефицита. Обычно он присутствует в развивающихся странах. Симптомы обычно следуют за плохой диетой, ведущей к недоеданию. Вторичный дефицит связан с нарушением всасывания липидов и хроническими заболеваниями, включая недостаточность желчевыводящих путей, цирроз печени, хроническую диарею, спру, болезнь Крона, недостаточность поджелудочной железы и др.
Дефицит витамина А более распространен во всем мире, чем интоксикация ретиноидами. Сбалансированная диета обычно обеспечивает необходимый физиологический уровень витамина А. В случаях, когда рекомендуемые уровни не достигаются, требуется добавка витамина А. Это имеет особое значение для младенцев и детей, где это вмешательство снижает уровень детской заболеваемости и смертности. На сегодняшний день добавление витамина А в развивающиеся страны считается одним из самых дорогостоящих мероприятий по улучшению выживаемости детей во всем мире, поскольку, согласно подсчетам, примерно одна треть младенческого населения в мире страдает гиповитаминозом А. Помимо детского населения, в развивающихся странах от этого дефицита страдают около 15% всех беременных женщин. Причина, скорее всего, в недоедании. Около 500 000 детей ежегодно страдают от ранней слепоты из-за дефицита витамина А. Однако, как было сказано выше, последствия дефицита гораздо шире и включают нарушение иммунитета, частые респираторные инфекции, гипоплазию эмали, кожные заболевания, дефекты мочеполовой и репродуктивной систем и аномалии костеобразования. В свете последствий дефицита витамина А для здоровья понятно, что недостаток витамина А может быть смертельным. Подсчитано, что этот дефицит является причиной смерти более 650 000 детей в год в развивающихся странах.
Также может проявляться субклинический дефицит витамина А, который обычно возникает при диетах, бедных овощами и мясом. Это опять-таки весьма актуально для менее развитых стран, но это может произойти и в развитых регионах. Кроме того, другие факторы могут напрямую влиять на метаболизм и общий уровень витамина А, например, потребление алкоголя. Считается, что у беременных употребление алкоголя является причиной фетального алкогольного синдрома, приводящего к тератогенности, частично из-за индуцированного дефицита витамина А. Однако уравновешенная диета обычно обеспечивает достаточный уровень витамина А, и, как правило, добавки не требуются даже во время беременности.
Широко распространенный дефицит витамина А, особенно в странах Африки к югу от Сахары и Южной Азии, привел к разработке множества проектов, направленных на биообогащение различных широко потребляемых пищевых продуктов в этих регионах. Биофортификация достигается различными способами, такими как селекция, агрономия и генетическая трансформация. Продукты, на которые нацелены проекты, включают рис, кукурузу, сладкий картофель, маниоку и бананы. Наиболее известен трансгенный золотой рис 2, содержащий до 37 мкг β-каротина на грамм риса, и его уже выращивают в некоторых странах.
7. Терапевтическое использование витамина А
Различные ретиноиды (Рисунок 1) используются в различных терапевтических целях. Помимо известных показаний при гиповитаминозах и кожных заболеваниях, ретиноиды успешно применялись при лечении рака. В то время как большинство ретиноидов обычно доступны в пероральных препаратах, ацитретин показан для местного применения.
В дополнение к недоеданию добавки с ретинолом также показаны при лечении кори, когда потребность в витамине А значительно повышена. Хотя эта инфекция практически не имеет значения в так называемых развитых странах, она по-прежнему остается одной из ведущих причин смерти в развивающихся странах. Таким образом, введение добавок в этих ситуациях значительно увеличивает выживаемость и улучшает нарушения зрения. Помимо кори, другие инфекции, поражающие желудочно-кишечный тракт и дыхательную систему, вызывают снижение синтеза RBP, что вторично снижает уровень витамина А в крови. показана длительная заместительная терапия ретинолом. Дополнительное лечение также может быть показано при других обстоятельствах, при которых наблюдается потеря ретинола, например, при длительном заживлении травм.
FDA одобрило ATRA для лечения кистозных угрей и некоторых видов рака, таких как некоторые виды лимфомы и лейкемии. Однако в последнее время спектр показаний был расширен за счет включения нескольких солидных опухолей (печень, легкие, меланома, рак груди и предстательной железы). Другими ретиноидами, используемыми при лечении рака, являются бексаротен и алитретиноин. Важно отметить, что развитие резистентности опухолей к лечению ATRA является обычным явлением. С другой стороны, бексаротен может избирательно связываться с RXR и модулировать экспрессию генов и пролиферацию клеток и успешно используется при лечении кожной Т-клеточной лимфомы. Алитретиноин использовался при саркоме Капоши, когда другие методы лечения оказались неэффективными. Основным недостатком этих синтетических производных являются их множественные побочные эффекты, которые они разделяют с другими ретиноидами, и эта проблема может быть более выражена с бексаротеном.
ATRA выполняет множество функций в организме и может использоваться в терапевтических целях для различных целей в зависимости от способа введения. В качестве местного средства его можно применять для лечения акне и фотостарения. Кроме того, противовоспалительный эффект ATRA может способствовать этим эффектам.
Ретиноиды часто используются при кожных заболеваниях: псориаз, фотоповреждения, себорея, акне, ихтиоз. Для этих целей обычно назначают АТРА, изотретиноин, адапален и ацитретин. Тем не менее, пациенты, получающие их, должны соблюдать некоторые меры предосторожности: избегать воздействия солнечных лучей, использовать другие средства местного лечения в той же области, откладывать беременность и т. д. При акне обычно рекомендуется изотретиноин из-за его активности в качестве местного бактерицида и его способность уменьшать воспаление благодаря своим ингибирующим свойствам в отношении моноцитов и нейтрофилов, а также способности к ремоделированию сальных желез.
Ацитретин является эффективным средством при псориазе даже в виде монотерапии. Он также используется для лечения дискоидной волчанки из-за его противовоспалительного и антипролиферативного действия. Однако, как и в случае с другими ретиноидами, он может вызывать побочные эффекты.
Другое расширенное использование ретиноидов встречается в косметической промышленности и в качестве пищевых добавок. Некоторые кремы для кожи часто содержат ретинилпальмитат, который может всасываться и метаболизироваться в ретинол, а затем в ATRA. Каротиноиды также широко используются в косметических препаратах из-за их увлажняющих свойств кожи. Каротиноиды также обладают хорошо известным защитным эффектом от УФ-излучения у людей, выступая в качестве экрана от солнечного излучения. Эта активность напрямую связана с их антиоксидантными свойствами и была в центре внимания нескольких исследований. Действительно, диеты, богатые каротиноидами, особенно β-каротином, были связаны с некоторой устойчивостью к воздействию солнечного света.
Прием добавок, содержащих ретиноиды, следует перед применением проконсультировать со специалистами. Важно отметить, что некоторые исследования показали потенциальную полезность ретиноидов в качестве терапевтических средств против болезни Альцгеймера.
8. Гипервитаминоз и токсичность витамина А
Интоксикация витамином А — довольно редкое состояние, но оно может произойти из-за усиленного приема витамина А или даже после введения ретиноидов в лечебных целях. Как указывалось ранее, токсичность ретиноидов может проявляться как при пероральном, так и при местном воздействии.
Гипервитаминоз считается, когда концентрация ретинола в плазме крови выше 2,09 мкМ. Токсичность обычно связана со злоупотреблением пищевыми добавками, но также может появиться после повышенного потребления пищи, богатой предварительно сформированным витамином А (печень, яйца и т. д.). Хроническая токсичность может появиться после длительного приема 10 мг/сут витамина А в течение нескольких месяцев у взрослых и 7,5–15 мг/сут у детей. В целом токсичность при приеме менее 30 мг/день (25 000–30 000 МЕ/день) встречается редко. Острая токсичность витамина А обычно проявляется после приема более 500 мг/сутки у взрослых, 100 мг/сутки у детей или 30 мг/сутки у младенцев. Однако эти пороговые уровни снижаются у лиц с чрезмерным употреблением алкоголя или с почечной недостаточностью. Кроме того, при приеме добавок витамина А наблюдались легкие побочные эффекты (жидкий стул, головная боль, раздражительность, лихорадка, тошнота и рвота), они редки и обычно быстро проходят при прекращении приема витамина А.
Гипервитаминоз А может проявляться несколькими симптомами, которые также зависят от возраста и функции печени. Внезапное чрезмерное потребление витамина А приводит к острому отравлению. Основными симптомами, наблюдаемыми при острой токсичности, являются тошнота, раздражительность, снижение аппетита, рвота, нечеткость зрения, головные боли, выпадение волос, мышечные боли, отек диска зрительного нерва, кровоизлияния, слабость, сонливость и изменение психического статуса. Эти симптомы довольно часты, тогда как внутричерепная гипертензия возникает редко. Идиопатическая внутричерепная гипертензия (псевдоопухоль головного мозга), синдром, характеризующийся головной болью, нечеткостью зрения, спутанностью сознания и повышенным внутримозговым давлением, также наблюдается у пациентов с чрезмерным потреблением витамина А или у тех, кто лечился изотретиноином. Гипертриглицеридемия является наиболее частым биохимическим побочным эффектом, обнаруживаемым после введения ретиноидов. Появляется через несколько недель после начала лечения. В конце концов, эти повышенные уровни триглицеридов приводят к повреждению печени, что, как следствие, вызывает фиброз и активацию звездчатых клеток печени, что приводит к возможному необратимому повреждению печени. С другой стороны, пероральные ретиноиды могут вызывать трещины на губах, головную боль, приливы, боли в животе, головокружение и потерю координации.
Как следствие, выработка кожного сала снижается, что уменьшает толщину эпидермиса и изменяет барьерную функцию кожи. Эти и другие кожные эффекты (сухость кожи, зуд, общее и кончиков пальцев), включая алопецию, также появляются при этом типе токсичности, но обычно исчезают после прекращения лечения. У хронических больных, помимо описанных выше острых симптомов, могут появиться бессонница, гипотиреоз, разрушение костей, анемия, утомляемость, диарея, сухость и зуд кожи, шелушение кожи и слизистых оболочек, гепатоспленомегалия, гипертрофия печени, артериальная гипертензия, фиброз, склероз и цирроз.
Кроме того, местное введение ретиноидов может быть связано со значительными симптомами. Ретиноиды для местного применения могут вызывать покраснение кожи (эритему), шелушение кожи (вторичное по отношению к гиперпролиферации эпидермиса) и дискомфорт. Другие побочные эффекты включают преходящую гипопигментацию или гиперпигментацию, псориаз, аллергический контактный дерматит и эктропион (веки вывернуты наружу).
Важно отметить, что передозировка ретиноидов может вызвать так называемый «синдром ретиноевой кислоты». Это состояние проявляется острым респираторным дистресс-синдромом с одышкой, плевральными и перикардиальными выпотами, лихорадкой, увеличением массы тела, отеками и даже полиорганной недостаточностью.
Как правило, лечение гипервитаминоза основано на прекращении приема витаминов. Большинство признаков и симптомов (острая ретиноидная токсичность, гипертриглицеридемия, кожные симптомы и симптомы со стороны ЦНС) постепенно исчезают после прекращения приема. Тем не менее, некоторые из этих симптомов, например шелушение кожи, сохраняются в течение нескольких месяцев. Введение ацетазоламида снижает внутричерепное давление. Однако могут возникнуть необратимые последствия для ЦНС. Сухость глаз после гипервитаминоза лечится глазными каплями.
Ретиноиды также тератогенны. Некоторые из тератогенных эффектов введения ретиноидов беременным женщинам включают черепно-лицевые, сердечные, тимусные нарушения и аномалии ЦНС у плода. Поскольку пероральные ретиноиды как животного, так и синтетического происхождения обладают тератогенным действием, женщины, получающие синтетические ретиноиды, должны избегать беременности в течение значительного периода времени даже после прекращения лечения. В некоторых случаях, например, после лечения изотретиноином, рекомендуется 2 года. Однако их применение у беременных может быть показано в тех случаях, когда польза, обеспечиваемая терапией, превышает риск и всегда под наблюдением врача. Детям (младше 5 лет) с риском дефицита рекомендуется добавление витамина А, и доказано, что оно снижает смертность в этой группе пациентов. Уровень ретинола следует контролировать у пациентов, страдающих заболеваниями печени и почек, алкоголизмом, акне. У пациентов, получающих добавки с витамином А, следует периодически контролировать уровень триглицеридов. Повышение уровня ферментов печени обычно незначительное и обратимое, но его также следует контролировать. Мониторинг качества костной ткани рекомендуется только у пациентов, получающих несколько курсов изотретиноина, или если пациент проходит длительное лечение. Если у пациента в анамнезе заболевание почек,
Каротиноиды считаются безопасными соединениями. Значительная токсичность встречается очень редко. При избыточном потреблении каротиноидов появляется оранжево-желтоватая окраска кожи (каротинодермия или каротинемия). Эти симптомы полностью обратимы; они исчезают со временем после прекращения приема каротиноидов. Диагностически это состояние дифференцируют от желтухи из-за отсутствия пигментации склер. Вероятной причиной является упомянутая выше регуляция метаболизма провитаминов А. Однако каротинемия редко была связана с появлением нефротического синдрома, заболеваний печени, гипотиреоза и других состояний. С другой стороны, противоречивые данные были опубликованы в финском исследовании, в котором сообщается о повышенной смертности от сердечно-сосудистых заболеваний и даже заболеваемости раком легких в когорте курящих людей с высоким потреблением β-каротина. Взаимосвязь между бета-каротином и раком легких также была описана в разделе 4.2.1.
9. Выводы
Значительная часть населения регулярно потребляет пищевые добавки и препараты, содержащие множество микронутриентов, в том числе витамины. Распространено мнение, что эти препараты являются безопасными продуктами, но каждый год сообщается о нескольких тысячах случаев отравления из-за использования этих продуктов. Витамин А является хорошим примером. С одной стороны, он необходим для правильного функционирования организма, а с другой, его избыточное потребление проявляется рядом симптомов интоксикации.
Популяризация использования Интернета и легкий доступ к тоннам информации создают риск широко распространенной дезинформации. Основным результатом является повышенный риск злоупотребления пищевыми добавками теми, кто ведет более здоровый образ жизни. Среди этих групп беременные женщины, дети и пожилые люди должны предпочтительно проконсультироваться со специалистами, прежде чем принимать какие-либо из этих добавок, которые могут иметь пагубные последствия для их здоровья. Типичным примером является β-каротин, потребление которого считается скорее положительным. Однако курильщикам следует избегать его использования в пищевых добавках. С другой стороны, назначение различных препаратов со свойствами витамина А полезно для лечения ряда заболеваний, но медицинские специалисты всегда должны руководствоваться такими показаниями.
Учитывая важность витамина А во многих важнейших физиологических процессах, его дефицит может представлять серьезную проблему для здоровья, а в самых серьезных случаях даже привести к смерти. В то же время это может привести к серьезным проблемам со здоровьем в ситуациях с высокими дозами. Этот обзор обобщил совокупность знаний о витамине А сложным образом. Помимо хорошо зарекомендовавших себя знаний, главным образом о происхождении и токсичности микроэлемента, в этой рукописи подробно описаны молекулярные пути его функционирования в организме человека и новейшие методы, используемые для оценки его количества в образцах человека.