Болезнь Гентингтона (БХ) — нейродегенеративное заболевание, вызванное увеличенным повтором CAG в экзоне 1 HTT .ген. БХ обычно проявляется в среднем возрасте с потерей ГАМКергических проекционных нейронов из полосатого тела, что сопровождается прогрессирующей атрофией скорлупы, за которой следуют другие области мозга, но связь между генетикой и нейродегенерацией не понятна. Мы измерили метаболические нарушения в головном мозге человека с БХ в исследовании случай-контроль, выявив повсеместное снижение уровня витамина В5, обязательного предшественника кофермента А (КоА), необходимого для нормального промежуточного метаболизма. Дефицит церебрального пантотената является недавно выявленным метаболическим дефектом при БХ человека, который потенциально может: (i) нарушать биосинтез КоА в нейронах; (ii) стимулируют активность полиолового пути; (iii) нарушать гликолиз и активность цикла трикарбоновых кислот; и (iv) модифицировать метаболизм мочевины в головном мозге.
1. Введение
HD представляет собой медленно прогрессирующее аутосомно-доминантное нейродегенеративное заболевание с широкими, но отчетливыми фенотипами, характеризующимися непроизвольными движениями, нарушением координации, снижением когнитивных функций, изменениями личности и психическими проявлениями. Это вызвано расширенным нестабильным (CAG)n-повтором на хромосоме 4p16.3 в экзоне 1 гена HTT, который кодирует измененную форму белка гентингтина, содержащего удлиненный полиглутаминовый тракт, состоящий из 37 или больше остатков глутамина. Оценочные затраты на соответствующую медицинскую и социальную помощь только в Великобритании составляют около 200 миллионов фунтов стерлингов в год.
Нейропатологическим признаком БХ является постепенная потеря средних шипиковых ГАМКергических проекционных нейронов неостриатума с медленной атрофией хвостатого ядра, скорлупы и внешнего сегмента бледного шара. По мере ухудшения заболевания атрофия симметрично распространяется по всему мозгу с прогрессирующей потерей паренхимы из следующих анатомических областей в порядке убывания тяжести: белое вещество головного мозга, таламус, кора головного мозга и мозжечок. На конечной стадии мозг обычно диффузно меньше, чем в норме, обычно теряет около 200 г (16,0%) по сравнению с контрольной группой того же возраста, при этом наибольшее повреждение произошло в дорсальном полосатом теле (скорлупе и хвостатом ядре). Степень потери массы головного мозга при терминальной стадии БХ в среднем аналогична таковой при болезни Альцгеймера (БА) и составляет ~200 г (15,7%), что согласуется с аналогичным широко распространенным повреждением тканей в обоих случаях. БХ вызывает прогрессирующую потерю как нейрональных, так и ненейрональных клеток в пораженных областях мозга, поражая как серое, так и белое вещество и демонстрируя выраженный гипометаболизм глюкозы, измеренный с помощью визуализации головного мозга.
Изменения в многочисленных молекулярных процессах в головном мозге, а также в других органах вовлечены в патогенез БХ, но как они могут быть связаны с лежащими в основе мутациями в гене HTT, еще предстоит определить. Одно из недавних направлений исследований было сосредоточено на применении профилирования метаболитов в исследованиях мозга, чтобы пролить новый свет на патобиологию нарушений ЦНС, хотя на сегодняшний день такие применения были несколько ограничены. Возмущения, приводящие к потенциально токсигенным уровням малых полярных метаболитов, включая глюкозу, сорбит, фруктозу, глюкозо-6-фосфат и мочевину, в настоящее время идентифицированы в головном мозге при БХ. Эти результаты указывают на изменения в центральных путях энергетического метаболизма, включая гликолиз, полиоловый путь, цикл трикарбоновых кислот (TCA) и цикл мочевины / метаболизм мочевины в головном мозге, в патогенезе HD.
Репликационные исследования необходимы для поддержки и расширения подходов к профилированию метаболитов, эффективность которых в головном мозге до сих пор тщательно не изучалась. Таким образом, мы провели повторное и расширенное исследование, чтобы лучше охарактеризовать рабочие характеристики нашего подхода к метаболическому профилированию ткани головного мозга с акцентом на случаи HD и соответствующие элементы управления. Мы стремились оценить эффективность наших аналитических методов и воспроизводимость результатов, полученных с течением времени, чтобы подтвердить наше предыдущее исследование метаболического профилирования и повысить нашу способность искать дальнейшие информативные метаболические нарушения. Мы оценили четыре различных аспекта нашей методологии: (1) воспроизводимость количественных измерений внутри анализа; (2) стабильность метаболитов в обработанных образцах во время пребывания в аналитическом оборудовании; (3) точность измерений полярных метаболитов в течение 1 года; и (4) стабильность метаболитов в мозге человека при длительном хранении образцов мозга.
Мы проанализировали мозговую ткань с короткой посмертной задержкой из 30 случаев HD и 19 контрольных, полученных из банка человеческого мозга Новозеландского неврологического фонда (Центр исследований мозга, Оклендский университет, Новая Зеландия), используя те же критерии, что и в нашем предыдущем исследовании. исследование, чтобы оптимизировать процессы, с помощью которых собирали ткани, и свести к минимуму изменчивость в обращении с тканями.
Мы провели два независимых эксперимента по газовой хроматографии-масс-спектрометрии (ГХ-МС) по типу «случай-контроль», в которых мы проанализировали в общей сложности 98 образцов ткани головного мозга, половину из мозжечка (CB) и половину из верхней лобной извилины (SFG) из 30 HD. носители мутаций и 19 человек из контрольной группы. Мы использовали всесторонние реплики контроля качества для измерения воспроизводимости внутри анализа, точности и стабильности метаболитов. Мы использовали нашу методологию ГХ-МС для воспроизводимой идентификации и количественного определения 63 различных полярных метаболитов в этих тканях мозга, группы метаболитов включали «метаболиты глюкозы и пентозы»; «альтернативные источники топлива»; «TCA и цикл мочевины и родственные промежуточные продукты»; 'аминокислоты'; «нуклеозиды»; и «разное», включая нейротрансмиттеры.
Интересно, что в этом исследовании витамин В5 (пантотеновая кислота), небольшая молекула, которая является обязательным первичным предшественником в пути биосинтеза КоА, занял первое место среди всех метаболитов, значительно измененных по содержанию в мозге человека с БХ по сравнению с контролем. Витамин B5 является важным микроэлементом, который присутствует в мозге в концентрациях, в 50 раз превышающих концентрацию в плазме. Его использование в пути биосинтеза КоА определяется событием фосфорилирования, катализируемым ферментом пантотенаткиназой (PanK), который у людей имеет различные изоформы, продуцируемые четырьмя различными генами, PANK1-4; мутации в одном из них, PANK2, вызывают нейродегенерацию. Среди множества своих функций CoA участвует в формировании архитектуры клеток головного мозга благодаря своим критическим ролям во многих различных биосинтетических путях. КоА превращается в ацетил-КоА под действием пируватдегидрогеназы и обеспечивает основной субстрат для цикла ТСА во всех клетках. Ацетил-КоА является обязательным кофактором примерно для 4% всех ферментов млекопитающих, он играет ключевую роль в контроле клеточного роста, пролиферации и глобального ацетилирования гистонов, а также в путях анаболизма и/или катаболизма углеводов, жирных кислот, липиды и фосфолипиды, холестерин, аминокислоты, водорастворимые витамины, белки и РНК. Кроме того, витамин B5 участвует через ацетил-КоА в производстве стероидных гормонов и ацетилхолина в головном мозге.
Здесь мы стремились определить, как витамин B5 физиологически распределяется в мозге человека и как его уровни в ЦНС могут быть затронуты у носителей HD-мутации. Поэтому мы использовали ГХ-МС для количественного определения витамина B5 в 12 анатомически различных областях в HD и контрольном мозге. Наши данные показывают, что концентрации витамина B5 были значительно снижены у носителей мутации HD в 8 из 12 областей мозга, которые мы проанализировали, и что глобальное снижение содержания витамина B5 присутствует в мозге HD.
Мы пришли к выводу, что дефицит витамина B5 является недавно обнаруженным метаболическим дефектом в головном мозге пациентов, страдающих БХ. Генетически опосредованные дефекты пути биосинтеза, посредством которого витамин В5 превращается в КоА, вызывают нейродегенерацию и деменцию у людей, что вполне может быть связано с недостаточным уровнем КоА в мозге. Таким образом, наши данные о повсеместном снижении уровня витамина B5 в мозге, пораженном БХ, взятые вместе с убедительными доказательствами связи дефектного биосинтеза КоА с механизмами нейродегенерации у людей, указывают на то, что дефицит витамина В5 может привести к нейродегенерации и деменции при БХ, и что эти дефекты можно предотвратить путем лечения витамином B5.
2. Результаты
В этом исследовании случай-контроль мы сопоставили субъектов по возрасту и посмертной задержке (PMD).Таблица 1). Масса головного мозга была значительно выше у контрольной группы, чем у носителей мутации HD (U Манна-Уитни, p <0,0001), что согласуется с развитой нейродегенерацией, обычно наблюдаемой в случаях поздних стадий. Изученный мозг HD варьировался от невропатологической степени Vonsattel от 0 до 4, и все случаи были гетерозиготными по мутациям HTT , с патологическими длинами трактов CAG, которые варьировались от 39 до 53 повторов (дополнительная таблица S1). Мы измерили содержание 63 метаболитов в двух регионах (CB, SFG) из 30 случаев с HD и 19 контролей (дополнительная таблица S1).
Чтобы иметь высокую степень уверенности в нашем исследовании, мы тщательно проверили надежность используемой аналитической платформы и качество измерений метаболитов в проанализированных образцах тканей. Во-первых, мы оценили внутритестовую воспроизводимость полного цикла ГХ-МС. Каждый цикл включал аналитическую партию из 49 экстрактов метаболитов, восемь объединенных контрольных проб (КК) и два контрольных образца с физиологическим раствором; они были дериватизированы с помощью ТМС, а затем проанализированы с помощью ГХ-МС в течение ~43 ч/цикл. В репликах пула контроля качества ( n = 8) из экстрактов CB почти все метаболиты (97%) имели значения %CV <20%, что указывает на превосходную воспроизводимость внутри анализа (Рисунок 1А). Мы получили эквивалентные результаты для объединенных экстрактов из образцов QC, полученных из SFG (Рисунок 1С). Мы также измерили изменчивость средних содержаний в группах метаболитов, используя объединенные в QC повторы из CB, в течение времени пребывания в автосэмплере GC (~ 43 часа). Проанализированные группы включали аминокислоты, сахара, нуклеозиды и метаболиты, связанные с циклом ТСА/циклом мочевины, все из которых имели значения CV <10%; другие группы метаболитов имели значения CV <15%. Эти результаты показывают, что задержка времени проведения ГХ не оказывала существенного влияния на стабильность метаболитов (Рисунок 1Б, Д). Чтобы оценить точность нашей платформы ГХ-МС в течение всего периода исследования, мы рассчитали коэффициенты корреляции, полученные путем сравнения содержания метаболитов в обработанных репликах КК, проанализированных с помощью ГХ-МС сразу и через год. Мы наблюдали сильную корреляцию между образцами QC, демонстрируя превосходную стабильность аналитической платформы в течение этого времени ( r = 0,96; p <0,0001;Рисунок 1Е). Наконец, мы оценили стабильность метаболитов в образцах ткани головного мозга человека при длительном хранении. Чтобы исследовать это, метаболиты были извлечены в различных случаях с использованием повторов ткани головного мозга в качестве исходного материала; Затем экстракты анализировали с помощью ГХ-МС для сравнения содержания метаболитов при длительном хранении. Небольшая вариабельность, наблюдаемая в корреляционном анализе, даже для метаболитов с низким содержанием, указывает на то, что хранение образцов оказывает минимальное влияние на общее качество наших измерений ГХ-МС ( r = 0,98; p <0,0001;Рисунок 1Ф). Взятые вместе, минимальная изменчивость, вызванная процедурами обработки образцов и применяемым аналитическим методом, поддерживает превосходное качество набора данных, полученного здесь.
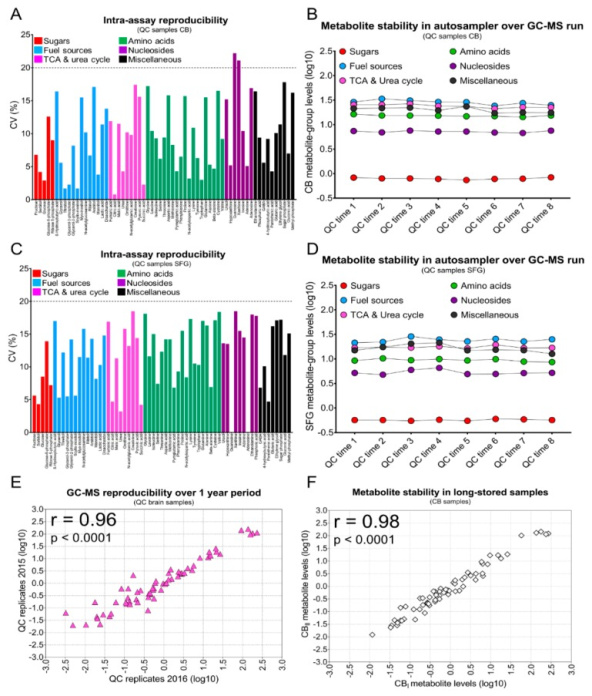
Воспроизводимость анализа ГХ-МС и стабильность метаболитов при длительном хранении. ( A , C ) Гистограммы иллюстрируют воспроизводимость ГХ-МС между анализами 63 метаболитов, количественно определенных в образцах контроля качества из CB и SFG, соответственно. Повторы контроля качества объединенных экстрактов головного мозга использовались для оценки воспроизводимости измерений. Для каждого метаболита показан коэффициент вариации (%) в отдельных областях мозга. ( Б , Д) Точечные диаграммы, показывающие, насколько стабильны группы метаболитов в образцах для контроля качества в ходе последовательности ГХ-МС продолжительностью ~43 часа. В этом исследовании восемь повторов контроля качества использовались для оценки воспроизводимости и исследования стабильности метаболитов образцов CB и SFG. Всего для оценки воспроизводимости и стабильности использовали 16 гомогенатов образцов головного мозга человека. ( E ) Отдельные диаграммы рассеяния, показывающие корреляцию между измерениями метаболитов в повторах контроля качества, проанализированных с помощью ГХ-МС в 2015 г. ( n = 12) и 2016 г. ( n = 12). Коэффициенты корреляции Пирсона ( r ) и соответствующие значения p показаны в верхнем левом углу каждой панели диаграммы рассеяния, а сообщаемые значения метаболитов были преобразованы в логарифмическом масштабе . (F ) Индивидуальные диаграммы рассеяния, показывающие корреляцию между измерениями метаболитов в давно хранящихся биологических репликах CB ткани мозга, извлеченных в 2015 и 2016 годах соответственно и проанализированных с помощью ГХ-МС. Коэффициенты корреляции Пирсона ( r ) и соответствующие значения p показаны в верхнем левом углу каждой панели диаграммы рассеяния, а сообщаемые значения метаболитов были преобразованы в логарифмическом масштабе.
Мы использовали эту методологию ГХ-МС для изучения влияния мутации HD на содержание метаболитов в головном мозге человека. Был проведен многофакторный анализ основных компонентов (PCA) образцов CB и SFG ( n = 49: 19 контролей, 30 HD) и метаболитов (всего 63) (фигура 2А, Б). На графике PCA для анализа CB носители мутации HD были плохо отделены от контроля с небольшим перекрытием между группой случаев и контролем (PC1 = 29%, PC2 = 22,7%;фигура 2А). Точно так же умеренный эффект разделения был очевиден на графике PCA метаболитов SFG (PC1 = 31,4%, PC2 = 14,3%;фигура 2Б). Мы следовали этому анализу с помощью моделирования ортогональных проекций на дискриминантный анализ скрытых структур (OPLS-DA) с использованием одного ортогонального компонента и одного прогностического значения с проверкой анализом перестановок (фигура 2CD). График оценки OPLS-DA и график p (corr) s для данных, полученных CB, показывают кластеризацию HD и контрольных групп, а также индивидуальный вклад метаболитов в разделение двух групп соответственно (фигура 2С; Дополнительный рисунок S2A ). С помощью анализа взвешенных суммарных коэффициентов абсолютной регрессии на модели CB OPLS-DA мы измерили 10 основных метаболитов, ответственных за разделение в образцах CB, которые включали в порядке убывания: витамин B5, сорбит, сцилло-инозитол, глюкозу, аденин, фруктозу, яблочная кислота, глутаровая кислота, мочевина и лимонная кислота ( дополнительные данные S1 ). Модель SFG OPLS-DA показала картину кластеризации, аналогичную той, что была получена для образцов CB (фигура 2Д; Дополнительный рисунок S2B ), однако несколько из десяти метаболитов, вносящих наибольший вклад в разделение на группы, различались, а именно: витамин B5, глицерол-2-фосфат, мочевина, фруктоза, сорбит, глицерол-3-фосфат, N-ацетилглутаминовая кислота, сцилло-инозитол. , маннит и цистеин. Для дальнейшего изучения влияния мутации HD на регуляцию метаболитов был проведен исследовательский парный корреляционный анализ с иерархической кластеризацией для CB и SFG, и результаты каждой группы сравнивались. Различные модели корреляции и кластеризации наблюдались между контрольной группой и пациентами с HD как в образцах CB, так и в SFG, что свидетельствует о дисфункциональной регуляции метаболизма в определенных областях мозга при HD.фигура 2Э–Н). Кроме того, корреляционный анализ показал, что метаболиты, участвующие в качестве продуктов метаболизма аминокислот и промежуточных продуктов полиолового пути, были одними из основных факторов, влияющих на картину кластеризации, полученную из образцов CB и SFG у пациентов с HD (фигура 2Э–Н). Список метаболитов, использованных для построения графиков PCA, моделей OPLS-DA и корреляционного анализа, показан в дополнительной таблице S2 .
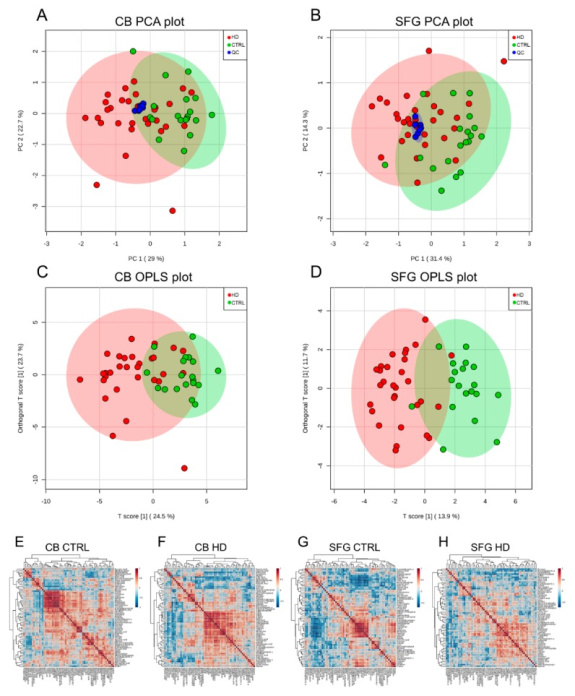
Показаны тепловые карты PCA, OPLS-DA и иерархической корреляции образцов мозга CB и SFG, проанализированных с помощью GC-MS. ( A , B ) Графики PCA, показывающие ограниченное разделение классов в областях мозга CB и SFG между случаями HD (красные кружки) и контролем (зеленые кружки). В выборках КБ первая главная компонента (ПК 1) объясняет 29,0 % общей дисперсии у обследованных испытуемых, вторая (ПК 2) еще 22,7 %. В SFG PC1 представляет 31,4% от общей дисперсии, тогда как PC2 составляет 14,3%. Различные условия (HD по сравнению с контролем) могут быть разделены только частично на графиках PCA. Компактная кластеризация, наблюдаемая между повторами контроля качества (синий кружок), подтверждает высокую степень воспроизводимости используемого здесь анализа ГХ-МС. ( С , Д) Результаты модели OPLS-DA для областей мозга CB и SGF в HD (красные кружки) и контроле (синие кружки). Наблюдается ограниченное разделение между случаями БГ и контролем в обеих областях мозга, проанализированных с помощью ГХ-МС. Цветные эллипсоиды вокруг каждой группы представляют 95% доверительные интервалы. ( E – H ) Тепловые карты иерархической корреляции, иллюстрирующие дифференциальную кластеризацию и совместное регулирование количества метаболитов в CB (левые панели E , F ) и SFG (правые панели G , H) в контроле и у носителей мутации HD. Метаболиты были сгруппированы с помощью алгоритма евклидова расстояния, а различия между совместной регуляцией количества метаболитов были исследованы с помощью корреляционного анализа Пирсона. Значения коэффициента корреляции Пирсона ( r ) визуально отображаются в шкалах цветового градиента в правой части каждой тепловой карты.
Чтобы получить представление о глобальном ремоделировании метаболитов, вызванном патогенной мутацией HTT в мозге человека, мы провели анализ HC, объединив текущий набор данных с другими, полученными параллельно нашей группой, с тем же оптимизированным рабочим процессом ГХ-МС для профилирования (Рисунок 3). Неконтролируемые HC разделили HD и контрольных субъектов на три основных кластера, что указывает на то, что при наличии мутации HD в определенных областях мозга происходит устойчивая дисрегуляция метаболитов. В частности, CB, MTG и SFG, три области, относительно сохранные до поздних стадий HD, показали наиболее похожий профиль кластеризации между HD и контрольными субъектами (Рисунок 3). Вместо этого на основе профиля содержания метаболитов были получены пять основных кластеров. Наиболее релевантные кластеры были обогащены метаболитами метаболизма галактозы (кластер 4, p = 7,57 × 10–5 , FDR-corr), интермедиатами цикла лимонной кислоты (TCA) (кластер 2, p = 1,35 × 10–4 , FDR-corr). ) и метаболизм бета-аланина (кластер 1, p = 6,26 × 10 -4 , FDR-corr).
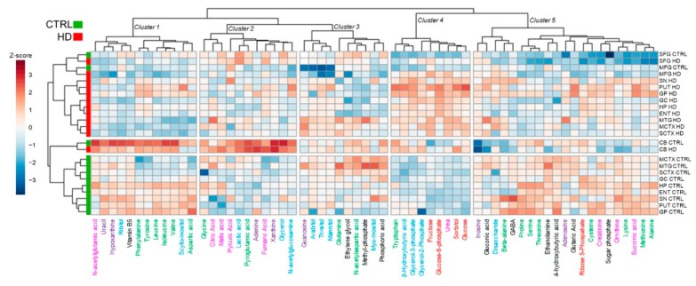
Анализ с помощью иерархической группировки содержания метаболитов в контроле и мозге HD. Это показывает существенное разделение между контрольной группой (зеленый) и случаями HD (красный) по областям мозга. Интересно, что наиболее значительная кластеризация присутствует в кластере 4 ( p = 7,57 × 10-5 , FDR-corr), который в основном обогащен категориями метаболитов, таких как альтернативные источники топлива, сахара и мочевина. Метод евклидова расстояния использовался для иерархической кластеризации; значения выражены в виде Z-показателей и визуально представлены в виде шкалы цветового градиента.
Из 63 малых молекул, количественно определенных в образцах CB, 40 имели значительно измененные уровни HD по сравнению с контрольным мозгом ( p <0,05 FDR-corr; дополнительная таблица S2 ;Рисунок 4А). Эти изменения охватывают различные классы метаболитов, включая сахара, источники топлива, промежуточные продукты, связанные с циклом мочевины/трициклочевины, аминокислоты, нуклеозиды и другие. В SFG было обнаружено, что 16 метаболитов значительно изменены при БХ, хотя нуклеозиды не входили в классы малых молекул, измененных в этой области мозга ( p <0,05 FDR-corr; дополнительная таблица S2 ;Рисунок 4Б). Из всех метаболитов, количественно определенных в этом исследовании, витамин B5 (пантотеновая кислота) продемонстрировал наиболее выраженное изменение HD в обеих исследованных областях мозга (CB: p = 7,96 × 10-6 FDR -corr, SFG: p = 7,18 × 10-8) . FDR-corr, дополнительная таблица S2 ;Рисунок 4А, Б). Витамин B5 расположен в центре структуры КоА и, следовательно, играет центральную роль в метаболизме КоА и во всех последующих путях, использующих КоА в качестве важного кофактора. Для количественной оценки содержания витамина B5 в образцах головного мозга была построена калибровочная кривая путем добавления известных количеств синтетической пантотеновой кислоты в фоновые матрицы головного мозга, а затем эта кривая использовалась для определения путем интерполяции региональных концентраций этого метаболита в тканях контрольной группы. и HD-мозг (R 2 = 0,9951; дополнительная фигура S1). В дополнение к CB и SFG мы распространили количественную оценку уровней витамина B5 с помощью этой целевой системы анализа на другие области мозга, ретроспективно измерив количество пантотеновой кислоты в 10 дополнительных областях мозга. Концентрации витамина B5 в случаях HD были значительно ниже, чем в контроле, в 8 из 12 исследованных областей (CB, p = 6,2 × 10-5 ; SFG, p = 2,0 × 10-6 ; скорлупа (PUT), p = 0,041; сенсорная кора (SCTX), p = 0,046, бледный шар (GP), p = 0,013, поясная извилина (CG), p = 0,011, черная субстанция (SN), p = 0,002, гиппокамп (HP), p= 0,017); SN, область мозга, относящаяся к контуру базальных ганглиев, показала наибольшее снижение витамина B5 из всех исследованных тканей (Рисунок 4А;Таблица 2). В целом концентрация витамина B5 была значительно снижена до ~ 55% в целом в мозге HD по сравнению с контролем ( p = 3,83 × 10 -12 ) . Таблица 2). Интересно, что снижение уровня витамина B5 наблюдалось у носителей мутаций БХ в областях мозга, обычно связанных с минимальной потерей клеток, а именно в CB, SFG, CG и HP, что указывает на то, что снижение уровня витамина B5 в мозге случаев HD является не просто результатом генерализованной нейродегенерации. Кроме того, при сравнении контрольной группы со случаями БХ с меньшей степенью патологии головного мозга (классы Vonsattel 0/1/2) концентрации витамина B5 все еще были значительно снижены, что еще раз подтверждает гипотезу о том, что потеря клеток не может играть главную роль в истощении запасов витамина B5. наблюдается в HD ( дополнительная фигура S3 ).
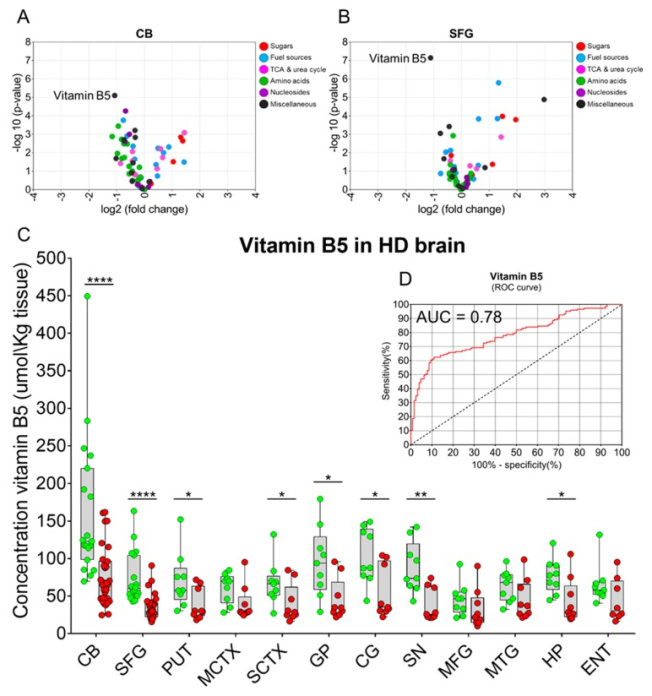
Доказательства того, что уровни витамина B5 снижаются в нескольких областях мозга при БХ. ( A , B ) Графики вулканов, показывающие отдельные метаболиты и группы метаболитов, дисрегуляция которых нарушена в мозге HD в CB и SFG соответственно. Витамин B5 (D-пантотеновая кислота) был наиболее значительно измененным метаболитом, идентифицированным в обеих областях мозга. ( C ) Распределение отдельных концентраций витамина B5 (мкмоль / кг ткани) с наложением агрегированных данных (коробчатые диаграммы) в каждой из 12 областей мозга контрольной группы (зеленые кружки) и случаев HD (красные кружки). Концентрации витамина B5 значительно снижены в CB, SFG, PUT, SCTX, GP, CG, SN и HP (двусторонний t- критерий для каждого региона). ( Д) Кривая рабочих характеристик приемника (ROC) для стратификации HD, основанная на измерениях витамина B5, была рассчитана с использованием концентраций витамина B5, экстраполированных из эталонной калибровочной кривой ( n = 278 образцов мозга). Значение AUC составило 0,78 при p < 0,0001. Здесь в исследуемую группу вошли все пациенты с ГБ ( n = 31, степень 0–4; красные кружки) и контрольная группа ( n = 24; зеленые кружки); блочные диаграммы представляют собой средние значения ± 95% ДИ. Сокращения: *, р < 0,05; ** <0,005, *** <0,001; ****, <0,0001; MCTX, моторная кора; MFG, медиальная лобная извилина; MTG, медиальная височная извилина; ЛОР, энторинальная кора.
Мы также исследовали, оказывает ли количество повторов HTT CAG какое-либо влияние на региональные уровни витамина B5 в контроле и мозге HD с помощью корреляционного анализа Спирмена. Здесь корреляции между концентрацией витамина B5 и длинами HTT CAG считались значимыми, если значения ρ были> 0,8 (или <-0,8) с соответствующими значениями p <0,01. Размер HTT CAG не был существенно связан с уровнями витамина B5 в контроле или случаях в любой исследованной области мозга ( дополнительная таблица S3); также концентрации витамина B5 в какой-либо области мозга не были значительно связаны со степенью Vonsattel, что согласуется с мнением о том, что величина потери клеток или общая нейродегенерация не способствуют измененным уровням витамина B5, наблюдаемым в случаях HD (дополнительная таблица S3 ) . Кроме того, возраст, ПМД или масса мозга существенно не связаны с региональными концентрациями витамина B5 в головном мозге ( дополнительная таблица S3 ). Более того, наши качественные наблюдения показывают, что ни индивидуальная причина смерти (COD), ни острые и хронические формы смерти не оказывали существенного влияния на региональное содержание витамина B5 в мозге человека в этой исследуемой популяции (дополнительная фигура S4A, B).
Хотя связь дефицита пантотеновой кислоты с заболеваниями ЦНС в значительной степени не изучена, было показано, что нарушение биосинтеза КоА из-за неиспользования витамина B5 является патогенным в подгруппе более крупного семейства нейродегенеративных заболеваний, называемых NBIA (нейродегенеративные расстройства). с накоплением железа в головном мозге), где аномальное накопление этого переходного металла наблюдается в базальных ганглиях. Чтобы выяснить, регулируются ли совместно Fe и витамин B5 в разных областях мозга при HD, мы провели предварительный корреляционный анализ с использованием наборов данных, полученных с помощью ICP-MS (индуктивно-связанная плазменная МС). В целом, мы наблюдали равное количество сильных корреляций между HD и контрольными группами, что согласуется с отсутствием значимых взаимосвязей между уровнями Fe и концентрациями витамина B5, как в контроле, так и у людей с HD (дополнительная фигура S5).
3. Обсуждение
Мотивация этого исследования была следующей. По данным Управления национальной статистики (https://www.ons.gov.uk), возрастная деменция в настоящее время опередила болезни сердца и стала основной причиной смерти в Соединенном Королевстве и в остальных странах развитого мира . БГ является одним из семи основных заболеваний, ответственных за возрастную деменцию, наряду с БА, сосудистой деменцией, болезнью Паркинсона, болезнью телец Леви, лобно-височной долевой дегенерацией и боковым амиотрофическим склерозом/заболеванием двигательных нейронов. Хотя каждая из этих возрастных деменций имеет специфические для заболевания характеристики, между некоторыми случаями также может быть значительное совпадение. В настоящее время не существует терапии, модифицирующей заболевание, для любого из этих заболеваний, которые в совокупности наносят огромный ущерб обществу. Отсутствие терапии, модифицирующей болезнь, предполагает необходимость новых подходов к изучению патогенеза деменции.
Дефекты в регуляции некоторых низкомолекулярных метаболитов могут нарушать их метаболизм в головном мозге и приводить к дефицитным состояниям, которые, если они достаточно тяжелые, могут вызывать или напоминать слабоумие или психические расстройства. Примеры включают дефицит водорастворимых витаминов (группы B), включая: тиамин (витамин B1); ниацин (витамин B3); витамин В6; фолиевая кислота (витамин В9); и цианокобаламин (витамин B12); и из основных липидов: линолевая кислота; и альфа-линоленовая кислота. Таким образом, набор метаболитов в головном мозге, называемый «метаболомом мозга», представляет интерес в качестве мишени для дальнейшего изучения патогенеза деменции. Дефицит витаминов группы В или незаменимых жирных кислот может вызвать широко распространенные нарушения функции мозга, которые (обычно) обратимы с помощью специфической заместительной терапии. Однако лечение распространенных возрастных деменций, например вызванных атопическим дерматитом, препаратами, содержащими витамины группы В (фолат и витамин В12), оказалось неэффективным.
Принимая во внимание эти наблюдения, мы решили провести систематический анализ низкомолекулярного метаболома при различных возрастных деменциях с помощью серии исследований случай-контроль на основе ГХ-МС посмертной ткани головного мозга. Поэтому мы разработали чувствительную и специфическую методологию и оптимизировали ее для использования в ткани головного мозга человека, чтобы мы могли систематически идентифицировать и количественно оценивать доступные низкомолекулярные аспекты метаболома мозга.
Здесь мы описываем подходы, с помощью которых наша платформа метаболомики ГХ-МС была эффективно оптимизирована, а затем использована для определения содержания метаболитов в тканях головного мозга человека, которые подвергались длительному хранению. Мы разработали это исследование для оценки ключевых аспектов качества измерений, полученных с использованием платформы, а именно воспроизводимости внутри анализа, стабильности метаболитов во время ГХ-обработки, стабильности платформы в течение года хранения и долговечности метаболитов в образцах мозга, хранящихся в −80 °С. Большинство измерений внутри анализа имели коэффициенты вариации (CV), которые были <15%, независимо от области, используемой для получения технических повторов QC. Это свойство согласуется с рекомендациями FDA относительно приемлемых стандартов прецизионности внутри анализа, указанных для валидации биоаналитических методов.
Мы также измерили стабильность в течение времени анализа и определили, что все контролируемые группы метаболитов имели CV <20% в течение типичного периода пребывания (время выполнения) ~ 43 часа. Другие исследователи обнаружили, что некоторые метаболиты склонны к деградации (или превращению в новые продукты распада) во время ожидания в автосэмплере; здесь, однако, метаболиты с выбранными классами аналитов существенно не изменились в течение продолжительного и непрерывного времени сбора данных МС, что поддерживает надлежащую оптимизацию нашего рабочего процесса.
Надежность и воспроизводимость платформ ГХ-МС также являются важными аспектами, которые следует учитывать при проверке надлежащего рабочего процесса для профилирования метаболитов. Чтобы оценить их, мы измерили содержание метаболитов в одних и тех же повторных образцах с разницей в один год, в то время как в то же время прибор регулярно использовался, среди прочего, для повторного анализа остальных образцов мозга, включенных в это исследование. Один и тот же набор метаболитов последовательно измерялся во всех образцах; возможно, что более важно, высокие значения корреляции были получены в повторах, что свидетельствует об отличной воспроизводимости. Следовательно, эти данные показывают, что наш рабочий процесс удивительно стабилен в течение этого длительного периода времени, что очень желательно в лонгитюдных исследованиях. Наши выводы согласуются с выводами других в различных приложениях в области метаболомики и других омических технологий.
Интервал хранения — еще одна важная переменная, которая потенциально может повлиять на правильное измерение аналитов в тканях, и подробные исследования, касающиеся эффектов длительного хранения образцов мозга, на сегодняшний день ограничены. Поэтому мы изучили влияние этого компонента, измерив уровни метаболитов в повторных образцах тканей в начале нашего исследования и после одного года криоконсервации при -80 ° C. Поскольку хранение не оказало существенного влияния на измеренные уровни аналитов, мы пришли к выводу, что наша платформа профилирования метаболитов может быть показана для расширения новых и текущих исследований, основанных на ткани головного мозга человека. Например, насколько нам известно, мы были первыми, кто применил нецелевой глобальный метаболический подход на основе ГХ-МС для получения подробной региональной карты изменений метаболитов, происходящих в мозге человека с БХ.
В то время как анализы человеческого мозга все еще осложняются внутренними элементами, которые трудно контролировать, например, посмертная задержка, в настоящее время изучаются новые подходы для преодоления этих ограничений.
Неконтролируемый кластерный анализ и статистическое моделирование, выполненные на основе данных этих анализов CB и SFG, показывают, что глубокие метаболические изменения существуют даже в областях мозга, где потеря клеток при HD не заметна. Следует отметить, что в этих данных явно присутствовала кластеризация метаболитов, фруктозы, глюкозо-6-фосфата, мочевины, сорбита и глюкозы, что повторяет и расширяет наши предыдущие результаты . Эта концепция также подтверждается несколькими недавними исследованиями. Дополнительные признаки нарушения регуляции метаболизма в умеренно пораженных областях головного мозга представлены данными об измененной регуляции цикла галактозы, бета-аланина и ТСА у носителей мутации БХ на ранних стадиях развития их заболевания, что согласуется с недостаточным энергетическим метаболизмом при БХ. В текущем исследовании мы наблюдали заметное снижение уровня витамина B5 в среднем до ~ 55% от соответствующих контрольных значений, что вполне могло привести к нарушению биосинтеза КоА в мозге при БХ. Поскольку КоА играет центральную роль во многих важных клеточных процессах, включая, например, цикл трикарбоновых кислот, пути метаболизма жирных кислот, порфиринов и полиаминов, биосинтез нейротрансмиттеров, таких как ацетилхолин, и регуляцию обмена аминокислот, белков, РНК и гистонов, возможно, что изменения на любом из этапов пути биосинтеза КоА могут влиять на правильное функционирование таких зависимых процессов. Интересно, что группа нарушений, связанных с путем биосинтеза КоА, имеет своей основной мишенью ЦНС, например, нейродегенерация, связанная с пантотенаткиназой (PKAN); они часто характеризуются, как и HD, когнитивными нарушениями, двигательными расстройствами, психическими особенностями и значительной нейродегенерацией головного мозга. Мы отмечаем доказательства того, что экспрессия и/или активность PANK1 может быть определяющим фактором физиологической регуляции внутриклеточной концентрации КоА. Уровни железа в базальных ганглиях значительно повышены у пациентов с БХ, а мутация PKAN сопровождается заметным отложением железа в пораженных областях мозга. Здесь мы обнаружили, что уровни витамина B5 и железа в мозге не коррелируют во всех исследованных областях, что указывает на то, что повышенное содержание железа может не способствовать снижению уровня витамина B5; эти данные также свидетельствуют о том, что снижение уровня витамина B5 при БХ может не быть обусловлено изменением активности PANK2. В настоящее время неизвестно, могут ли мутации HTT привести или вызвать дефицит витамина B5, и если да, то как . Здесь наш корреляционный анализ данных из 296 образцов ткани головного мозга не обнаружил связи между числом повторов CAG и уровнями витамина B5 в случаях или контроле. Дальнейшие исследования, в том числе измерение уровней КоА и ацетил-КоА в тканях с помощью опубликованных методов, а также пять связанных ферментов пути биосинтеза КоА, необходимы для изучения потенциальной роли измененной регуляции этого пути при БХ.
Наличие серьезных повышений уровней глюкозы, сорбитола, фруктозы, глюкозо-6-фосфата и мочевины в скорлупе головного мозга при БХ, как сообщалось в наших предыдущих публикациях, и дополнительно подтверждается здесь результатами Неконтролируемый кластерный анализ указывает на повышенный поток в полиольном пути в сочетании с дефектным использованием глюкозы посредством гликолиза, при котором имеется предполагаемый блок дистальнее катализируемой гексокиназой стадии фосфорилирования глюкозы.
Этот паттерн особенно влияет на участки мозга с высоким уровнем воздействия, например полосатое тело, и очень напоминает паттерн дефектов, который мы недавно обнаружили при БА. В физиологических условиях большая часть глюкозы, вступающей в гликолитический путь в головном мозге, предназначена для входа в цикл ТСА через катализируемое пируватдегидрогеназой образование ацетил-КоА, который, в свою очередь, является производным от его обязательного предшественника, витамина В5. Дефект этого пути, вызванный дефектным гомеостазом витамина B5, приводящим к нарушению образования КоА, обеспечивает потенциальный механизм, лежащий в основе этих наблюдений. Эту гипотезу необходимо будет проверить путем прямого измерения компонентов пути в будущих исследованиях случай-контроль на животных моделях и в тканях головного мозга человека.
Здесь мочевина сгруппирована с промежуточными продуктами полиолового пути и глюкозо-6-фосфатом, что указывает на потенциально взаимосвязанные дефекты в их родственных метаболических путях. Неизвестно, содержит ли ткань мозга полный, функционирующий цикл мочевины, и происхождение повышенного уровня мочевины в головном мозге при БХ и даже при БА остается неясным. Однако в нем экспрессируются несколько ферментов, имеющих отношение к биосинтезу и метаболизму мочевины, включая карбамоилфосфатсинтетазу, N-ацетилглутаматсинтазу, карбоангидразу и глутаматдегидрогеназу. Более того, существуют многочисленные молекулярные связи между циклом ТСА и метаболизмом мочевины, а также убедительные доказательства того, что взаимодействие этих путей зависит от ацетил-КоА как ключевого метаболита, общего для обоих.
Здесь мы определяем существенную потерю витамина B5 из базальных ганглиев и областей, функционально связанных через базальные ганглии и таламокортикальные цепи, включая лобную и сенсорную кору, бледный шар, скорлупу, черную субстанцию и поясную извилину. Интересно, что базальные ганглии, которые в первую очередь страдают от тяжелой потери клеток при БХ, начинают дегенерировать до того, как клинические симптомы станут отчетливо проявляться во время прогрессирования заболевания. Уровни витамина B5 в мозге обычно примерно в 50 раз выше, чем в плазме; эти запасы, вероятно, отражают высокую потребность в КоА для поддержки клеточного метаболизма, например, при синтезе ацетилхолина, и вполне могут указывать на связывание и секвестрацию во внутриклеточных структурах, чтобы снизить гипотетическую «свободную» фракцию для облегчения поглощения через мембраносвязанный транспортер SLC5A6.
Наши результаты указывают на возможный дефект в механизме церебрального поглощения и/или накопления витамина B5, что согласуется с его пониженными концентрациями в пораженных участках головного мозга. В то время как некоторые генетически передающиеся расстройства, вызывающие дефекты пути синтеза КоА, встречаются у людей, последствия хронического истощения витамина B5 на головной мозг плохо изучены. Человеческий натрий-зависимый поливитаминный переносчик (hSMVT), кодируемый геном SLC5A6 , опосредует поглощение пантотената вместе с биотином, липоатом и йодидом. SMVT человека является основным переносчиком пантотената через гематоэнцефалический барьер и мутация потери функции в SLCA6 .у людей вызывает дисфункцию головного мозга, среди других фенотипических эффектов. Эти наблюдения, взятые вместе с обнаружением дефицита витамина B5 в мозге БХ, указывают на hSMVT как на цель для дальнейшего изучения в отношении патогенеза БХ.
Ацетилхолин является основным нейротрансмиттером в головном мозге, локализованным в холинергических нейронах. Он образуется путем переноса ацетильной группы от ацетил-КоА к холину, катализируемого холин-О-ацетилтрансферазой (ChAT; EC 2.3.1.6). Большая часть ацетилхолина в мозге млекопитающих связывается и секвестрируется под действием везикулярного транспортера ацетилхолина, SLC18A3, в секреторных органеллах нервных окончаний. Субклеточная локализация витамина В5 в головном мозге в настоящее время неясна. Мы предполагаем, что, поскольку он является обязательным предшественником ацетил-КоА и, следовательно, ацетилхолина, потребность в котором высока в головном мозге, то его запасы также могут быть локализованы в холинергических нейронах, по крайней мере, частично. Для проверки этой гипотезы потребуются исследования совместной локализации.
У ацетил-КоА есть и другие важные регуляторные функции, которые могут иметь отношение к интерпретации наших текущих результатов. Например, он действует как регулятор метаболизма на стыке катаболизма углеводов, жиров и белков, который быстро истощается при голодании. Истощение ацетил-КоА, в свою очередь, вызывает снижение общего ацетилирования цитоплазматических белков наряду с индукцией аутофагии, гомеостатического процесса самопереваривания, а цитозольный ацетил-КоА может действовать как центральный метаболический регулятор аутофагии. Ацетил-КоА является основным донором ацетила для ацетилаз, которые катализируют ацетилирование гистонов, и тем самым способствует регуляции генов. Считалось, что углерод, полученный из глюкозы, является основным источником ацетил-КоА, используемого для ацетилирования гистонов. Однако недавно появились доказательства того, что липиды могут обеспечивать основной источник углерода для ацетилирования гистонов. Было обнаружено, что окисление жирных кислот увеличивает глобальное ацетилирование гистонов, и было показано, что липиды обеспечивают до 90% ацетил-углерода для ацетилирования гистонов, что в основном обеспечивается октаноатом; также было показано, что ацетил-КоА, полученный из липидов, усиливает экспрессию ферментов, метаболизирующих липиды. Эти результаты расширяют современное понимание роли ацетил-КоА в восприятии питательных веществ и регуляции метаболизма.
Это исследование имеет ограничения. Во-первых, исследуемая популяция из 30 больных БХ и 19 контрольных групп включала в общей сложности 49 субъектов; поэтому требуется дальнейшее повторение в независимых группах случаев и контролей, чтобы избежать неточностей в интерпретации, вызванных относительно небольшим размером выборки. Тем не менее, пониженные уровни витамина B5 присутствовали в нескольких функционально различных областях мозга, в том числе в тех, которые заметно различались по степени повреждения, поэтому нейродегенерация сама по себе вряд ли может дать достаточное объяснение для этих сниженных концентраций в тканях. Значение p , связанное с основным эффектом, по совокупным данным по всем регионам составляет 3,8 × 10–12, предоставляя доказательства того, что существенное мультирегиональное снижение витамина B5 происходит в головном мозге HD. Это исследование не может определить, могут ли выявленные метаболические нарушения, в частности дефицит витамина В5, сами по себе вызывать повреждение тканей, или же они возникают как последующие эпифеномены в патогенном процессе и не участвуют в механизме нейродегенерации. Однако имеющиеся существенные генетические данные указывают на нейродегенерацию, вызванную мутациями в центральном ферменте синтетического пути, который ведет от витамина B5 к КоА, а также в самом переносчике витамина B5, предоставляя убедительные доказательства связи между дефектами регуляции витамина B5 и невропатологией. Кроме того, текущие результаты не объясняют, как HTTмутации могут вызвать дефицит витамина B5 или дать какое-либо механистическое представление о том, как эти два процесса могут быть связаны. В то время как исследование образцов головного мозга БХ с умеренной потерей клеток предполагает, что нарушение регуляции витамина B5 может происходить на ранних стадиях процесса БХ, для подтверждения этих результатов потребуются исследования большего числа случаев БХ низкой патологической степени.
В заключение, мы разработали и утвердили надежный и воспроизводимый метод для идентификации и измерения основных метаболитов, присутствующих в низкомолекулярной фракции метаболома в мозге человека, и использовали его здесь для анализа исследования случай-контроль, целью которого было повторить и расширить наши более ранние исследования метаболических нарушений при БХ как окно в патогенез хронической возрастной деменции. Благодаря этим исследованиям мы выявили новое метаболическое нарушение, дефицит витамина B5, который потенциально может вызывать нейродегенерацию из-за нарушений регуляции ацетил-КоА, для которого он является обязательным предшественником. Это открытие в человеческом мозгу сообщается здесь впервые, насколько нам известно. Мы считаем, что это открытие важно, потому что оно повышает вероятность того, что часть патогенного процесса вHTT- опосредованная деменция может быть вызвана нарушением метаболизма витамина B5, что, в свою очередь, приводит к нарушению метаболизма ацетил-КоА и последующему повреждению тканей, вызванному многочисленными путями, которые он регулирует. Если дефицит витамина B5 действительно является частью патогенеза у пациентов с мутациями HTT , то его замена может быть новым вмешательством, способным остановить или подавить нейродегенерацию, аналогично эффектам замены других витаминов B в сценариях, где специфический Дефицитное расстройство является причиной нейродегенерации, например дефицита витамина B12. Мы считаем, что настало время начать рассмотрение доказательных путей, которые в конечном итоге приведут к испытаниям терапии витамином B5 при заболеваниях, вызванных HTT .мутация. Такое вмешательство может быть начато до того, как мутация HTT проявится в виде болезни Гентингтона.
4. Материалы и методы
4.1. Приобретение человеческого мозга
Мы получили образцы тканей от 30 случаев HD и 19 контрольных из банка человеческого мозга Новозеландского неврологического фонда, в Центре исследований мозга, факультет медицинских и медицинских наук, Оклендский университет, Окленд, Новая Зеландия. Все семьи дали информированное согласие, и Комитет по этике участников Оклендского университета одобрил все использованные процедуры.
4.2. Ткани человеческого мозга
Используемый здесь метод рассечения головного мозга человека был описан ранее. Короче говоря, каждая область мозга была идентифицирована и точно микропрепарирована обученными нейроанатомами. Мы собрали ткань из двух областей мозга для основных метаболомических исследований: мозжечка, CB; и верхняя лобная извилина, SFG. Мы вырезали образцы ткани по 50 ± 5 мг из каждой области от каждого субъекта, и они хранились при температуре -80 ° C до анализа.
4.3. Извлечение тканей для ГХ-МС
Мы использовали ранее описанный метод, с помощью которого аликвоты ткани весом 50 ± 5 мг экстрагировали в 0,8 мл смеси 50:50 ( об. / об. ) метанол:хлороформ, к которой добавляли раствор изотопно-меченых внутренних стандартов (лимонная кислота). кислоту-d4, 13C6-D-фруктозу, L-триптофан-d5, L-аланин-d7, стеариновую кислоту-d35, бензойную кислоту-d5 и лейцин-d10) в метаноле добавляли до конечных концентраций 0,016 мг/мл. каждого внутреннего стандарта в экстракционном растворителе. Мы смешивали образцы тканей (гомогенизатор TissueLyser bead; Qiagen, Великобритания) в течение 10 минут при 25 Гц с помощью 3 мм шарика из карбида вольфрама и проводили разделение фаз, добавляя 0,4 мл воды с последующим перемешиванием на вортексе (10–15 с) и центрифугированием. 2400 г, 5 мин) с последующим удалением слоя хлороформа. Из надосадочной жидкости метанол:вода аликвоты по 200 мкл переносили в предварительно маркированные пробирки и готовили контрольные повторы путем объединения равных количеств экстрактов из каждого образца с последующей сушкой аликвот (центробежный концентратор Speedvac; Thermo-Fisher, Waltham, MA). , США) и хранение при 4 °C до дериватизации для анализа ГХ-МС.
4.4. ГХ-МС и анализ данных
Ранее мы подробно описали метод, используемый для метаболомного анализа ГХ-МС. Вкратце, метоксимирование и триметилсилилирование использовались для создания профиля полярных низкомолекулярных метаболитов, таких как те, которые соответствуют аминокислотам, простым органическим кислотам и моносахаридам. Этот подход часто используется для получения сравнительных данных с использованием дизайна исследования случай-контроль. Данные обрабатывали с помощью ChromaTOF 4.5 (LECO), и результаты МС сопоставляли с двумя общедоступными спектральными библиотеками: базой данных Golm Metabolome (Институт молекулярной физиологии растений им. Макса Планка, Потсдам-Гольм, Германия); и Масс-спектральная справочная библиотека NIST (NIST08/2008; Национальный институт стандартов и технологий/Агентство по охране окружающей среды/Национальный институт здравоохранения Spectral 262 Library; NIST, Гейтерсберг, Мэриленд, США). Мы отслеживали хроматографическую изменчивость от серии к серии, от партии к партии и во времени, исследуя изменчивость времени удерживания внутренних эталонных стандартов. Чтобы определить однозначную идентификацию метаболитов в спектрах, согласованных с нашим программным обеспечением, два независимых исследователя вручную проверили масс-спектры/ожидаемое время удерживания и интеграцию формы пиков.
4.5. Извлечение тканей для масс-спектрометрии с индуктивно связанной плазмой (ИСП-МС)
Мы применили ранее оптимизированный метод, основанный на ИСП-МС, для определения концентраций металлов, нормированных на основе сухой массы, в ткани из девяти анатомически проверенных областей: PUT, MCTX, SCTX, GP, SN, MFG, MTG, HP и ЛОР. Образцы сырой массы 50 ± 5 мг обезвоживали до постоянной массы в центробежном концентраторе (Speedvac) и определяли соотношение влажной массы к сухой. Мы расщепляли высушенную ткань в микроцентрифужных пробирках объемом 2 мл (Eppendorf) с использованием концентрированной азотной кислоты (A509 Trace Metal Grade; Fisher, Loughborough, UK) с добавлением 5% (об./ об . )) Смесь внутреннего стандарта Agilent (5183-4681; Agilent Technologies, Cheadle, UK). Мы прокалывали крышки пробирок, чтобы предотвратить повышение давления, добавляли азотную кислоту, содержащую стандарт, а затем постепенно нагревали пробирки от комнатной температуры до 60 °C в течение 30 мин в блоке сухого нагрева; после этого мы повысили заданную температуру до 100 °C еще на 210 мин. Как только переваривание ткани было завершено, мы давали пробиркам остыть в течение ночи. Для обеспечения истинного бланка «переваривания» в каждую партию включали пробирки без тканей, содержащие стандартный раствор кислоты, а соответствующие разведения внутренней стандартизированной кислоты обеспечивали промывочные и калибровочные растворы в концентрации 2% (об./об . ) .) конечная концентрация азотной кислоты. Мы подготовили калибровочные растворы путем соответствующих разбавлений калибровочного стандарта окружающей среды (Agilent 5183-4688).
4.6. ICP-MS и анализ данных
Концентрации металлов определяли с использованием спектрометра Agilent 7700x ICP-MS, оснащенного распылителем MicroMist (Glass Expansion, Мельбурн, Австралия) и двухпроходной распылительной камерой Скотта с никелевым образцом и конусами скиммера. Мы вводили образцы с помощью встроенного автодозатора Agilent (I-AS) с гелием (He) в качестве газа столкновения и применяли многоэлементный метод, включая все элементы, присутствующие в калибровочном растворе, как описано ранее, и использовали скандий в качестве газа для столкновений . внутренний стандарт для всех элементов. Мы использовали два газовых режима ячейки столкновений: все элементы анализировались в гелиевом режиме (5,0 мл·мин -1Он). Выбор режима соответствовал рекомендациям компании Agilent, чтобы свести к минимуму помехи для измеряемых элементов, например, от изобарных кластерных ионов. Время интегрирования составляло 0,01 с для Fe. Для каждой аналитической партии мы выполнили многоэлементную калибровку с использованием серийных разведений калибровочного стандарта. Мы использовали промежуточную концентрацию из этой серии калибровок в качестве периодического образца для контроля качества в каждой аналитической партии. Бланки инструментов и расщепления также вкраплены в каждый набор рандомизированных образцов. Мы определили предел обнаружения Fe путем сравнения калибровочных образцов и холостых проб, и любые образцы ниже этого уровня были исключены до составления отчета.
4.7. Концентрация витамина B5, измеренная прицельным анализом ГХ-МС
Хроматографические данные о времени удерживания для витамина B5 были доступны в нашей внутренней библиотеке эталонных стандартов. Чтобы провести окончательную молекулярную идентификацию, правильное соответствие как масс-спектров/ожидаемого времени удерживания, так и интеграции формы пика было вручную проверено двумя независимыми исследователями ( дополнительный рисунок S1A ).
Для витамина B5 мы построили калибровочную кривую с использованием известных количеств подлинных синтетических стандартов для оценки стабильности соединения на нашей аналитической платформе (Sigma-Aldrich; дополнительный рисунок S1B ). Чтобы обеспечить количественную оценку витамина B5 в матрицах головного мозга человека, была создана дополнительная калибровочная кривая путем добавления стандартов чистой пантотеновой кислоты в экстракты образцов ( дополнительная фигура S1C ). Уровни витамина B5 были рассчитаны, и данные представлены здесь в мкмоль/кг свежей мозговой ткани.
4.8. Анализ данных и статистика
В текущем исследовании собственные биоинформатические алгоритмы, реализованные в R (версия 3.5.1) и Python (версия 3.6), использовались для интеллектуального анализа данных, визуализации данных и статистики, а также для изучения экспериментальных результатов. Воспроизводимость аналитической платформы оценивали путем расчета % коэффициента вариации (%CV) каждого метаболита в повторах QC. Здесь %CV < 20% был выбран в качестве надлежащего порога для определения хорошей воспроизводимости. Стабильность платформы оценивали путем расчета коэффициентов корреляции между относительным содержанием каждого метаболита (log10 преобразованных) в обработанных повторностях образцов QC и образцах мозга после длительного хранения соответственно.р -значения были не менее >0,95 и <0,001 соответственно. Многофакторный PCA и OPLS-DA были выполнены с использованием R (MetaboAnalystR; версия 1.0.1) для оценки качества данных и выявления глобальных химических различий в нескольких областях мозга в случаях HD и контрольной группе. Чтобы оценить достоверность OPLS-DA, были рассчитаны значения согласия модели, которые затем сравнивались с согласием 100 моделей с Y-перестановкой. Затем была рассчитана оценка VIP, мера важности переменной в модели OPLS-DA, и ее значения использовались для точного определения основных метаболитов, способствующих дифференциации, наблюдаемой в модели OLPS-DA, между HD и контрольной группой без деменции. U-критерий Манна-Уитни ( p <0,05) был применен для проверки значимости в модели. Множественный 2-хвостый т-тесты были применены, чтобы определить, наблюдались ли соответствующие различия в содержании метаболитов, и чтобы установить статистическую значимость наших наблюдений, мы рассмотрели все наши наборы данных для анализа множественных сравнений, применив 10% поправку на коэффициент ложного обнаружения. Мы рассчитали кратность изменения содержания метаболитов как отношение средних значений для каждой группы случай-контроль и представили их здесь как соотношение HD-группа/контрольная группа. Анализ иерархической кластеризации (HC) был построен с использованием собственных скриптов, реализованных в пакетах R (ggplot2 v2.2.1; pheatmap v1.0.8;heatmap.plus v1.3; Для создания тепловых карт кластеризации был применен метод евклидова расстояния. Непараметрические U-критерии Манна-Уитни и кривые рабочих характеристик приемника (ROC) (GraphPad v6.04 Prism; La Jolla, CA) использовались для оценки способности витамина B5 различать HD и здоровые контроли. Значение площади под кривой (AUC) рассчитывали путем численного интегрирования кривой. Значение соответствующего p-значение было установлено на уровне 0,001, а пороговое значение AUC — на уровне 0,75. В каждой области мозга было исследовано потенциальное влияние размера повтора CAG аллеля HTT на содержание витамина B5 путем создания корреляций Спирмена между количеством триплетов CAG и концентрацией витамина B5 с использованием реализаций сценариев статистического анализа и интеллектуального анализа данных, доступных на Python. модули (Pandas v0.23.3, NumPy v1.15.0, Matplotlib v2.2.2, SciPy v1.1.0 и Seaborn v0.9.0). Корреляция считалась значимой, только если и ρ-, и p-значения были не менее >0,8 (или <-0,8) и <0,01 соответственно. Аналогичные критерии использовались для исследования того, как степень патологии головного мозга (Vonsattel), возраст, PMD и масса мозга могут быть связаны с региональной концентрацией витамина B5 в мозге человека. Для анализа ICP-MS наборы данных экспортировали в рабочие листы Microsoft Excel, а отдельные значения каждого образца нормализовали по соответствующему сухому весу образца. Затем наборы данных с поправкой на вес были логарифмически преобразованы для статистического анализа. Были рассчитаны средние значения (±95% ДИ) данных, преобразованных в log10, и значимость межгрупповых различий была исследована с помощью непарного критерия t Уэлча.- тесты для учета неравных дисперсий и размеров выборки. Средние значения (±95% ДИ) были преобразованы обратно, чтобы отразить фактические концентрации элементов. Статистические расчеты и визуализацию данных проводили с помощью GraphPad v6.04 (Prism; Ла-Хойя, Калифорния, США). Корреляционные различия были статистически оценены методом преобразования Фишера r-to-z, и значения p <0,05 (двусторонние) считались значимыми.