Биотин является водорастворимым витамином и служит коферментом для пяти карбоксилаз в организме человека. Биотин также ковалентно связан с отдельными остатками лизина в гистонах, влияя на структуру хроматина и опосредуя регуляцию генов. В этом обзоре описывается метаболизм биотина у млекопитающих, анализ биотина, маркеры статуса биотина и биологические функции биотина. Белки, такие как холокарбоксилаза-синтетаза, биотинидаза и переносчики биотина SMVT и MCT1, играют решающую роль в гомеостазе биотина, и эти роли рассматриваются здесь. Обсуждаются возможные эффекты неадекватного потребления биотина, лекарственные взаимодействия и врожденные нарушения метаболизма, в том числе предполагаемые эффекты на врожденные дефекты.
1. История
Боас был первым, кто продемонстрировал потребность в водорастворимом витамине биотине у млекопитающих. Впоследствии был выделен биотин, установлена его химическая структура и осуществлен его химический синтез.
2. Биосинтез и катаболизм биотина
Млекопитающие не могут синтезировать биотин, но зависят от поступления в пищу микробных и растительных источников. Путь микробного биосинтеза биотина был в значительной степени разработан Айзенбергом и его сотрудниками в исследованиях Escherichia coli. В этом пути детиобиотин образуется из олеатного метаболита пимелил-КоА и карбамилфосфата. Сера включается в детиобиотин на синтазозависимой стадии, образуя биотин.
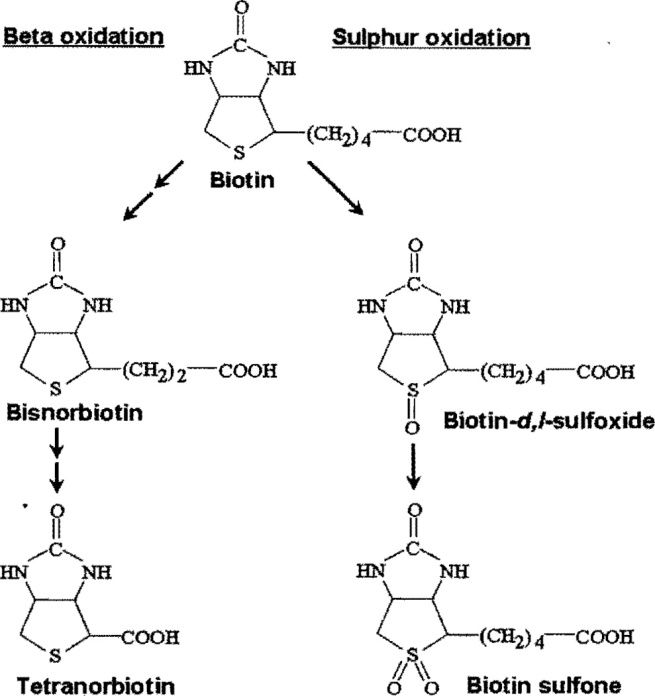
Ранние исследования катаболизма биотина в основном проводились с использованием микробов в качестве модельных организмов, но в значительной степени применимы и к млекопитающим. Маккормик и Райт определили два пути катаболизма биотина. В одном пути биотин катаболизируется путем β-окисления боковой цепи валериановой кислоты. Этот путь приводит к образованию биснорбиотина, тетранорбиотина и промежуточных соединений, которые, как известно, являются результатом β-окисления жирных кислот (т.е. α,β-дегидро-, β-гидрокси и β-кето-промежуточные соединения). Спонтанное декарбоксилирование β-кетобиотина и β-кетобиснорбиотина дает биснорбиотинметилкетон и тетранорбиотинметилкетон. После деградации биотина до тетранорбиотина микроорганизмы расщепляют и разлагают гетероциклическое кольцо; деградация гетероциклического кольца количественно незначительна у млекопитающих, во втором пути катаболизма биотина сера в гетероциклическом кольце окисляется с образованием биотин-/-сульфоксида, биотин- d -сульфоксида и биотинсульфона. Окисление серы в молекуле биотина происходит в гладком эндоплазматическом ретикулуме в реакции, зависящей от никотинамидадениндинуклеотидфосфата. Биотин также катаболизируется за счет комбинации β-окисления и окисления серы с образованием таких соединений, как биснорбиотинсульфон.
3. Биологические функции биотина
Биотин уже давно известен своей ролью ковалентно связанного кофермента для карбоксилаз. Совсем недавно появились доказательства того, что биотин также играет уникальную роль в клеточной передаче сигналов, эпигенетической регуляции генов и структуре хроматина.
3.1. Биотинзависимые карбоксилазы
У млекопитающих биотин служит ковалентно связанным коферментом для ацетил-КоА-карбоксилаз 1 и 2 (КФ 6.4.1.2), пируваткарбоксилазы (КФ 6.4.1.1), пропионил-КоА-карбоксилазы (КФ 6.4.1.3) и 3-метилкротонил- КоА-карбоксилаза (EC 6.4.1.4). Присоединение биотина к ε-аминогруппе определенного остатка лизина в апокарбоксилазах катализируется голокарбоксилазной синтетазой (HCS) (EC 6.3.4,10); биотинилирование карбоксилаз требует АТФ и протекает в следующие две стадии:
- АТФ + биотин + ГХС → биотин-АМФ-ГХС + пирофосфат
- Биотин-AMP-HCS + апокарбоксилаза → голокарбоксилаза + AMP + HCS
(Чистый) АТФ + биотин + апокарбоксилаза → холокарбоксилаза + и АМФ + пирофосфат
Биотинзависимые карбоксилазы опосредуют ковалентное связывание бикарбоната с органическими кислотами посредством следующей последовательности карбоксилирования. Сначала бикарбонат и АТФ образуют карбоксифосфат, высвобождая АДФ. Во-вторых, карбоксифосфат взаимодействует с 1'- N биотиниловой частью холокарбоксилазы («биотиниткарбоксилаза») с образованием 1'- N -карбоксибиотинилкарбоксилазы и высвобождением неорганического фосфата P i . В-третьих, 1'- N -карбоксибиотинилкарбоксилаза включает карбоксилат в акцептор, т.е. специфическую органическую кислоту для каждой из карбоксилаз.
Были идентифицированы две изоформы ацетил-КоА-карбоксилазы: цитоплазматическая ацетил-КоА-карбоксилаза 1 и митохондриальная ацетил-КоА-карбоксилаза 2. Обе ацетил-КоА-карбоксилазы 1 и 2 катализируют связывание бикарбоната с ацетил-КоА, образуя малонил-КоА. Ацетил-КоА-карбоксилаза 1 является ключевым ферментом синтеза жирных кислот в цитоплазме. Напротив, ацетил-КоА-карбоксилаза 2 участвует в регуляции окисления жирных кислот в митохондриях. Этот эффект ацетил-КоА-карбоксилазы 2 опосредуется малонил-КоА, который является ингибитором транспорта жирных кислот в митохондрии.
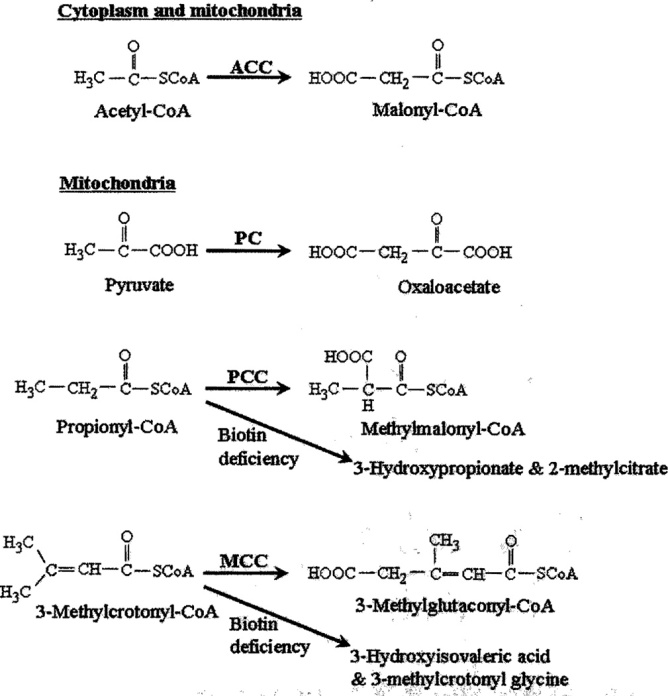
Биотинзависимые карбоксилазы. АСС, ацетил-КоА-карбоксилаза; МКЦ, 3-метилкротонил-КоА-карбоксилаза; PC, пируваткарбоксилаза; PCC, пропионил-КоА-карбоксилаза.
Пируваткарбоксилаза локализуется в митохондриях и является ключевым ферментом глюконеогенеза. Митохондриальные пропионил-КоА-карбоксилаза и 3-метилкротонил-КоА-карбоксилаза содержат биотинсодержащие альфа-субъединицы и бета-субъединицы, не содержащие биотин. Пропионил-КоА-карбоксилаза катализирует важный этап метаболизма изолейцина, валина, метионина, треонина, боковой цепи холестерина и жирных кислот с нечетной цепью. β-Метилкротонил-КоА-карбоксилаза катализирует важный этап метаболизма лейцина. Дополнительные карбоксилазы были идентифицированы у некоторых микробов, но здесь не обсуждаются.
Протеолитическая деградация холокарбоксилаз приводит к образованию биотиниловых пептидов. Эти пептиды далее расщепляются биотинидазой (BTD) (EC 3.5.1.12) с высвобождением биотина, который повторно используется в синтезе холокарбоксилазы.
3.2. Эпигенетика
3.2.1. Хроматин и генная регуляция
Хроматин состоит из ДНК и ДНК-связывающих белков, то есть историй и негистоновых белков. Истории играют решающую роль в укладке ДНК в хроматине. У млекопитающих идентифицировано пять основных классов гистонов: линкерный гистон H1 и коровые гистоны H2A, H2B, H3 и H4. Гистоны состоят из глобулярного домена и более гибкого N-концевого хвоста. ДНК и гистоны образуют повторяющиеся нуклеопротеиновые единицы, нуклеосомы. Каждая нуклеосома («нуклеосомная коровая частица») состоит из 147 пар оснований ДНК, обернутых вокруг октамера коровых гистонов (один тетрамер H3-H3-H4-H4 и два димера H2A-H2B).
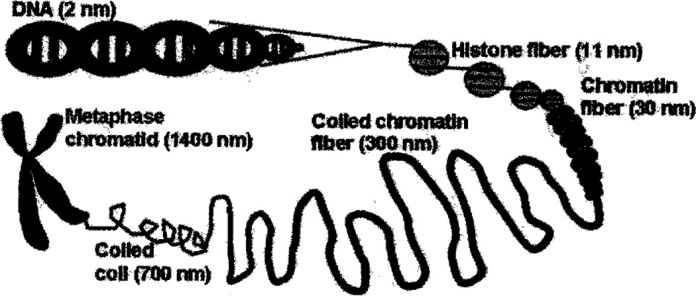
N-концевые хвосты коровых гистонов выступают из поверхности нуклеосом; ковалентные модификации этих хвостов влияют на структуру хроматина и составляют основу регуляции генов. Аминокислотные остатки в хвостах гистонов модифицируются путем ковалентного ацетилирования, метилирования, фосфорилирования, убиквитинирования и поли(АДФ-рибозилирования). Различные модификации гистонов имеют разные функции. Напр., триметилирование K4 в гистоне H3 связано с транскрипционной активацией окружающей ДНК, тогда как диметилирование K9 связано с молчанием транскрипции. Ковалентные модификации гистонов обратимы.
3.2.2. Биотинилирование гистонов
Имеются доказательства того, что биотин присоединяется к гистонам (ДНК-связывающим белкам) посредством амидной связи. В гистонах человека идентифицированы следующие 11 сайтов биотинилирования: лизин (К)-9, К13, К125, К127 и К129 в гистоне Н2А; K4, K9, K18 и, возможно, K23 в гистоне H3; и K8 и K12 в гистоне H4
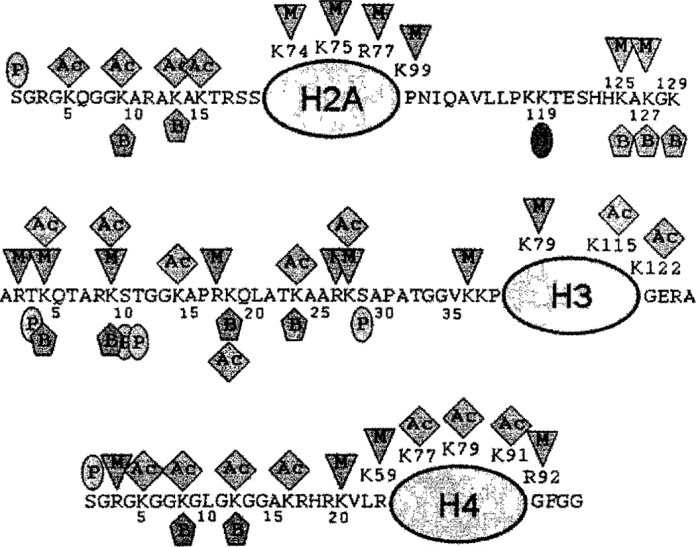
Появляются функции биотинилирования гистонов в биологии хроматина. Например, биотинилирование K12 в гистоне H4 играет роль в репрессии генов, репарации ДНК, структур гетерохроматина и репрессии транспозонов, тем самым способствуя стабильности генома. Важно отметить, что биотинилирование гистонов зависит от поступления биотина с пищей.
Первоначально считалось, что биотинилирование гистонов катализируется БТД. Хаймс и др. предложили механизм реакции, посредством которого расщепление биоцитина (биотин-ε-лизина) с помощью BTD приводит к образованию промежуточного соединения биотинил-тиоэфира в активном центре BTD или рядом с ним. На следующем этапе биотинильная часть переносится из тиоэфира в ε-аминогруппу лизинов в истории. Субстрат (биоцитин) для биотинилирования историй образуется при распаде биотин-зависимых карбоксилаз.
Последующие исследования Narang et al. представили доказательства того, что HCS может также биотинилировать гистоны. Несмотря на способность BTD катализировать биотинилирование гистонов, исследования Camporeale et al. предполагают, что HCS более важен, чем BTD для биотинилирования гистонов. Важно отметить, что нокдаун HCS или BTD снижает биотинилирование гистонов, вызывает аномальные паттерны экспрессии генов и вызывает такие фенотипы, как снижение продолжительности жизни и термоустойчивости у Drosophila melanogaster. Эффекты нокдауна BTD, вероятно, связаны с нарушением рециркуляции биотина, что вызывает дефицит биотина.
3.2.3. Дебиотинилирование гистонов
Биотинилирование гистонов является обратимой модификацией, но механизмы, опосредующие дебиотинилирование гистонов, в значительной степени неизвестны. Недавние исследования предполагают, что BTD может катализировать как биотинилирование, так и дебиотинилирование гистонов. Такие переменные, как микроокружение (доступность субстрата) в хроматине, взаимодействия белок-BTD, посттрансляционные модификации и альтернативный сплайсинг BTD, теоретически могут определять, действует ли BTD как биотинилгистонтрансфераза или гистондебиотинилаза. Доступен анализ дебиотинилазы гистонов.
3.3. Экспрессия генов
Около 40 лет назад появились данные, свидетельствующие о том, что биотин может влиять на экспрессию генов; эти новаторские исследования предоставили доказательства того, что экспрессия глюкокиназы печени крысы (EC 2.7.1.2) зависит от биотина. С тех пор в лимфоидных клетках и клетках печени человека было идентифицировано более 2000 биотинзависимых генов. Эти гены не распределены случайным образом в геноме человека, но могут быть отнесены к генным кластерам на основе сигнальных путей, хромосомной локализации, клеточной локализации генных продуктов, биологической функции и молекулярной функции. Были предоставлены доказательства того, что биснорбиотин также влияет на экспрессию генов, предполагая, что катаболиты биотина могут иметь активность, подобную биотину, у людей. Эффекты биотина на экспрессию генов опосредованы различными клеточными сигналами, включая биотинил-АМФ, цГМФ, NF-kB, Sp1 и Sp3 и рецепторные тирозинкиназы.
Были предоставлены доказательства того, что биотин также влияет на экспрессию генов на посттранскрипционном уровне. Например, экспрессия рецептора асиалогликопротеина в клетках гепатокарциномы HepG2 и пропионил-КоА-карбоксилазы в гепатоцитах крыс зависит от биотина; эти эффекты не вызваны изменениями количества мРНК, кодирующей эти белки.
4. Методы анализа биотина
4.1. Анализы микробного роста
Микроорганизмы, такие как Lactobacillus plantarum, Lactobacillus casei, Ochromonas danica, Escherichia coli C162, Saccharomyces cerevisiae и Kloeckera brevis , нуждаются в биотине для роста и обычно используются в анализах микробного роста. Эти тест-организмы демонстрируют различные реакции роста на биотин и предшественники биотина, катаболиты и аналоги. Для некоторых микробов (например, Ochromonas danica, Lacto-bacillus plantarum) требуется кислотный или ферментативный гидролиз образцов для высвобождения биотина из белка. Напротив, для других организмов (например, Kloeckera brevis) определяемый биотин снижается при ферментативном гидролизе.
4.2. Анализы связывания авидина
Белки авидин и стрептавидин широко используются в анализе биотина, поскольку они связывают биотин с исключительной силой и специфичностью; константа диссоциации авидин-биотинового комплекса составляет 1,3 × 10–15 М. Анализы связывания авидина обычно измеряют способность биотина конкурировать с [3H] биотином или [14C] биотином за связывание с авидином; для предотвращения связывания авидина, конъюгированного с ферментом, с биотинилированным белком, прикрепленным к пластику; или для предотвращения связывания биотинилированного фермента с авидином. Стрептавидин обладает большей специфичностью к биотину, чем авидин, и, следовательно, обычно является предпочтительным белком в анализах связывания (стрепт) авидина.
Анализы связывания авидина сопряжены со следующими потенциальными ловушками. Во-первых, авидин менее прочно связывает катаболиты биотина по сравнению с биотином. Следовательно, анализы связывания авидина могут недооценивать истинную концентрацию биотина плюс катаболиты, если они откалиброваны с использованием биотина. Во-вторых, соединения, структурно сходные с биотином (например, липоевая кислота, мочевина, гексановая кислота), могут связываться с авидином и вызывать искусственно завышенные значения «кажущегося биотина». В совокупности авидин-связывающие соединения в биологических образцах необходимо разделить с помощью хроматографии перед анализом отдельных хроматографических фракций в сравнении с аутентичными стандартами. Соответствующие аналитические процедуры были рассмотрены в другом месте.
4.3. Анализ красителя 4'-гидроксиазобензол-2-карбоновой кислоты
Это простой анализ для количественного определения биотина в концентрациях, превышающих те, которые обычно обнаруживаются в биологических образцах. В отсутствие биотина 4'-гидроксиазобензол-2-карбоновая кислота образует нековалентные комплексы с авидином в местах связывания биотина с образованием характерной полосы поглощения при 500 нм. Добавление биотина к этому комплексу приводит к вытеснению 4'-гидроксиазобензол-2-карбоновой кислоты из мест связывания. По мере замещения 4'-гидроксиазобензол-2-карбоновой кислоты оптическая плотность комплекса пропорционально снижается.
5. Пищеварение, всасывание, хранение и выделение.
5.1. Пищеварение
Большая часть пищевого биотина ковалентно связана с остатками лизина в белках. Желудочно-кишечные протеазы и пептидазы расщепляют биотинсодержащие белки с высвобождением биоцитина (биотинил-ε-лизина) и биотинсодержащих пептидов. BTD высвобождает свободный биотин из биоцитина и биотинилированных пептидов; Активность BTD можно обнаружить в жидкости поджелудочной железы и других кишечных выделениях, кишечной флоре и мембранах щеточной каймы. Первичныйе сайты гидролиза биотинилированных пептидов неизвестны. Небольшие количества биотимилированных пептидов могут абсорбироваться без предварительного гидролиза.
5.2. Поглощение
Транспорт биотина через апикальную мембрану в мембране щеточной каймы происходит посредством натрий-зависимого, электронейтрального механизма, тогда как транспорт через базолатеральную мембрану является натрий-независимым и электрогенным. Кажущаяся константа Михаэлиса-Ментен переносчика биотина в тощей кишке мыши составляет 22 мкмоль/л. Натрий-зависимое поглощение биотина кишечником опосредуется натрий-зависимым транспортером поливитаминов SMVT, который также имеет сродство к пантотеновой кислоте и липоевой кислоте. Пассивная диффузия через клеточные мембраны может способствовать поглощению биотина, если внеклеточная концентрация биотина превышает 25 мкмоль/л; опосредованное переносчиком поглощение преобладает при концентрациях биотина менее 5 мкмоль/л. Активность переносчика биотина в кишечнике зависит от поступления биотина с пищей и регулируется протеинкиназой С совместно с Ca 2+ /катмодутин-опосредованными путями и факторами транскрипции KLF-4 и AP-2. Был предложен механизм, с помощью которого биотинилирование гистонов в локусе промотора SMVT регулирует экспрессию гена SMVT и, следовательно, скорость транспорта биотина. Дозы биотина, которые превышают нормальное потребление с пищей в 600 раз, являются биодоступными на 100%.
5.3. Поглощение, хранение и распределение в печени и периферических тканях.
SMVT не только опосредует всасывание биотина в кишечнике, но также имеет решающее значение для поглощения биотина в печени и периферических тканях, а также для реабсорбции в почках. Были предоставлены доказательства того, что монокарбоксилатный транспортер 1 может отвечать за поглощение биотина в некоторых клеточных линиях, таких как лимфоидные клетки и кератиноциты.
Относительно большая часть введенного внутривенно биотина накапливается в печени крыс, что согласуется с ролью этого органа в хранении биотина. Эксперименты по истощению и восполнению биотин-зависимых карбоксилаз в печени крыс предоставили доказательства того, что митохондриальная ацетил-КоА-карбоксилаза 2 может служить резервуаром для биотина. Обратите внимание, что центральная нервная система (ЦНС) сохраняет большую часть своего биотина во время фаз истощения за счет других тканей, таких как печень. В ЦНС крысы биотин обогащен в определенных областях, таких как двигательная система мозжечка и слуховые ядра ствола мозга, что коррелирует с соответствующими неврологическими симптомами, связанными с дефицитом биотина.
5.4. Клеточные отсеки
Биотин неравномерно распределяется по клеточным компартментам. Подавляющее большинство биотина в печени крыс локализуется в митохондриях и цитоплазме, тогда как лишь небольшая часть локализуется в микросомах. Относительное обогащение биотином митохондрий и цитоплазмы согласуется с ролью биотина как кофермента для карбоксилаз в этих компартментах. Количественно небольшая, но качественно важная фракция биотина локализуется в ядре клетки, т.е. около 0,7% всего биотина в лимфоидных клетках человека может быть извлечено из ядерной фракции. Относительное количество ядерного биотина увеличивается примерно до 1% от общего биотина в ответ на пролиферацию, что согласуется с ролью гистонов в клеточной пролиферации.
5.5. Мочевая и желчная экскреция
Здоровые взрослые люди выделяют ~100 нмоль биотина и катаболитов в день с мочой. Биотин составляет примерно половину от общего количества; катаболиты биснорбиотин, биотин- d,l -сульфоксиды, биснорбиотинметилкетон, биотинсульфон и тетранорбиотин-/-сульфоксид составляют большую часть баланса. Если физиологические или фармакологические дозы биотина вводятся парентерально людям, крысам или свиньям, 43–75% дозы выводится с мочой. Почечный эпителий восстанавливает биотин, который фильтруется в клубочках в процессе, опосредованном SMVT. Билиарная экскреция биотина и катаболитов количественно незначительна. Менее 2% внутривенной дозы биотина выводится с желчью крыс, но более 60% дозы выводится с мочой.
Таблица 1. Концентрация биотина и катаботитов в сыворотке и выделение с мочой
| Сложный |
Сыворотка (пмоль/л) |
Моча (нмоль/24 ч) |
|---|---|---|
| биотин | 244 ± 61 | 35 ± 14 |
| Биснорбиотин | 189 ± 135 | 68 ± 48 |
| Биотин- d,l -сульфоксид | 15 ± 33 | 5±6 |
| Биснорбиотин метилкетон | НД а | 9±9 |
| Биотин сульфон | НД а | 5±5 |
| Всего биотиниловых соединений | 464 ± 178 б | 122 ± 66 |
Приведены средние значения ± стандартное отклонение ( n = 15 для сыворотки; n = 6 для мочи).
НД - не определено. Метилкетон биснорбиотина и сульфон биотина не были идентифицированы в то время, когда проводилось это исследование сыворотки, и, следовательно, количественная оценка этих «неизвестных веществ» была основана на использовании биотина в качестве стандарта.
b - Включая три неидентифицированных катаболита биотина.
6. Статус биотина
6.1. Прямые меры
Экскреция биотина и биотиновых катаболитов с мочой быстро и существенно снижается у людей с дефицитом биотина, что позволяет предположить, что экскреция с мочой является ранним и чувствительным индикатором дефицита биотина. Снижение экскреции биотина с мочой вместе с увеличением отношения биснорбиотина и биотин- d,l -сульфоксида к биотину отражают повышенный катаболизм биотина, наблюдаемый у курящих женщин. Напротив, сывороточные концентрации биотина, биснорбиотина и биотин- d,l -сульфоксида не снижаются у лиц с дефицитом биотина и у пациентов, получающих полное парентеральное питание без биотина в течение разумных периодов наблюдения. Следовательно, концентрации в сыворотке не являются хорошими индикаторами предельного дефицита биотина.
6.2. Косвенные меры
Активность биотинзависимых карбоксилаз в лимфоцитах является надежным маркером для оценки биотинового статуса человека. Некоторые исследователи использовали модифицированный подход и рассчитали «индекс активации карбоксилазы», представляющий отношение активности карбоксилазы в клетках, инкубированных с избытком дополнительного биотина, к клеткам без дополнительного биотина. Высокие значения индекса активации предполагают, что значительная часть данной карбоксилазы присутствует в виде апофермента, что указывает на дефицит биотина.
Снижение активности карбоксилаз при дефиците биотина влияет на промежуточный метаболизм. Снижение активности β-метилкротонил-КоА-карбоксилазы ухудшает катаболизм лейцина. Как следствие, β-метилкротонил-КоА переключается на альтернативные пути, что приводит к повышенному образованию 3-гидроксиизовалериановой кислоты и 3-метилкротонилглицина. Исследования дефицита биотина у людей предполагают, что экскреция 3-гидроксиизовалериановой кислоты с мочой является ранним и чувствительным индикатором статуса биотина.
Снижение активности пропионил-КоА-карбоксилазы вызывает метаболический блок в метаболизме пропионовой кислоты. Следовательно, пропионовая кислота направляется на альтернативные метаболические пути. В этих путях образуются 3-гидроксипропионовая кислота и 2-метилцитриновая кислота. Однако недавние исследования на людях с дефицитом биотина показывают, что экскреция с мочой 3-гидроксипропионовой кислоты и 2-метилцитриновой кислоты не является хорошим показателем предельного дефицита биотина. Теоретически пропионовая кислота может потребляться при синтезе жирных кислот с нечетной цепью. При тяжелом дефиците биотина может снижаться активность пируваткарбоксилазы, что приводит к накоплению лактата.
7. Дефицит биотина
7.1. Клинические проявления явного дефицита биотина
Признаки явного дефицита биотина были описаны у пациентов с дефицитом BTD, у детей с тяжелым истощением в развивающихся странах и у лиц, потребляющих большое количество сырого яичного белка, содержащего белок авидин. Связывание биотина с авидином в желудочно-кишечном тракте предотвращает всасывание биотина. Клинические проявления явного дефицита биотина включают периорифициальный дерматит, конъюнктивит, алопецию, атаксию, гипотонию, кетолактацидоз/органическую ацидурию, судороги, инфекции кожи и задержку развития у младенцев и детей.
7.2. Иммунная система, пролиферация клеток и стрессоустойчивость
Дефицит биотина оказывает неблагоприятное воздействие на клеточные и гуморальные иммунные функции. Например, у детей с наследственными аномалиями метаболизма биотина развился кандидозный дерматит и отсутствовали кожные тесты замедленной гиперчувствительности, дефицит IgA и субнормальный процент Т-лимфоцитов в периферической крови. У грызунов дефицит биотина снижает синтез антител, уменьшает количество клеток селезенки и процентное содержание В-лимфоцитов в селезенке и нарушает созревание тимоцитов. Снижение скорости пролиферации клеток может вызывать некоторые эффекты биотина на иммунную функцию.
Дефицит биотина также связан с клеточным стрессом, усиливающим ядерную транслокацию фактора транскрипции NF-κB в лимфоидных клетках человека. NF-κB опосредует активацию антиапоптотических генов; это связано с повышенной выживаемостью клеток с дефицитом биотина в ответ на сигналы гибели клеток по сравнению с контролем с достаточным количеством биотина. Стрессоустойчивую дрозофилу можно отобрать, кормя несколько поколений диетами с дефицитом биотина.
7.3. Липидный обмен
В соответствии с ролью биотин-зависимых ацетил-КоА-карбоксилаз 1 и 2 и пропионил-КоА-карбоксилазы в метаболизме липидов дефицит биотина вызывает изменения профиля жирных кислот в печени, коже и сыворотке некоторых видов животных. Дефицит биотина связан с повышенным содержанием жирных кислот с нечетной цепью, что позволяет предположить, что накопление жирных кислот с нечетной цепью может быть маркером снижения активности пропионил-КоА-карбоксилазы при дефиците биотина. Дефицит биотина не влияет на состав жирных кислот в тканях головного мозга в такой степени, как в печени.
Дефицит биотина также вызывает аномалии в составе жирных кислот у человека. У пациентов, у которых во время парентерального питания развился дефицит биотина, процент жирных кислот с нечетной цепью (15:0, 17:0) в сыворотке увеличивался для каждого из четырех основных классов липидов, то есть эфиров холестерина, фосфолипидов, триглицеридов и свободных жирных кислот . кислоты. Однако относительные изменения в этих четырех классах липидов не всегда были последовательными в исследованиях.
7.4. Тератогенные эффекты дефицита биотина
Мок и его коллеги предположили, что около половины беременных женщин в США испытывают незначительный дефицит биотина, несмотря на нормальное потребление биотина с пищей. Если бы существовала связь между предельным дефицитом биотина и пороками развития плода у людей, выводы Мок и его коллег имели бы важные последствия для политики здравоохранения и рекомендаций по потреблению. На сегодняшний день эта связь несколько ненадежна. Хотя исследования на животных ясно продемонстрировали, что дефицит биотина является тератогенным, тяжесть дефицита в этих исследованиях на животных обычно превышала то, что наблюдалось у беременных женщин. Несмотря на эти ограничения, тератогенные эффекты дефицита биотина на животных моделях требуют краткого описания. У некоторых линий мышей дефицит биотина во время беременности вызывает значительное увеличение пороков развития плода и смертности. Наиболее распространенные пороки развития плода у крыс с дефицитом биотина включают расщепление неба, микрогнатию и микромелию. Были получены доказательства того, что катаболизм биотина в биснорбиотин повышен у беременных женщин по сравнению с небеременными контрольными. Мок и его коллеги сообщили, что активность пропионил-КоА-карбоксилазы снижается примерно на 90% у плода в срок в ответ на кормление яичным белком, который вызывает только 50% снижение активности пропионил-КоА-карбоксилазы в печени матери.
7.5. Гомеостаз биотина в ЦНС
Нарушения гомеостаза биотина в ЦНС вызывают энцефалопатии. Факторы, приводящие к дисбалансу биотина в ЦНС, включают дефицит BTD, HCS и, возможно, переносчиков биотина, как описано ниже. Пораженные пациенты обычно реагируют на введение больших доз биотина с сохранением нормальной неврологической функции.
Умеренный дефицит диетического биотина обычно не связан с неврологическими симптомами. Это согласуется с гипотезой о том, что в условиях умеренного дефицита биотина ЦНС поддерживает нормальные концентрации биотина за счет других тканей. Действительно, были предоставлены доказательства того, что дефицит биотина вызывает > 90% снижение биотинилированных карбоксилаз в печени крыс, тогда как карбоксилазы головного мозга остаются неизменными. Тканеспецифический ответ на поступление биотина, вероятно, обусловлен тканеспецифическими изменениями экспрессии.
8. Врожденные нарушения метаболизма биотина.
8.1. Дефицит БТД
Низкая активность фермента BTD приводит к невозможности рециклировать биотин из деградированных карбоксилаз, т.е. высвобождать биотин из биоцитина. Значительное количество биоцитина выделяется с мочой, что в конечном итоге приводит к дефициту биотина. Таким образом, клинические и биохимические особенности у детей с дефицитом БТД аналогичны описанным ранее для дефицита биотина.
Как правило, симптомы дефицита BTD появляются в возрасте от 1 недели до >1 года. Вольф различает пациентов с глубоким дефицитом BTD (менее 10% нормальной активности BTD в сыворотке) и пациентов с частичным дефицитом (10–30% нормальной активности BTD). Были предложены процедуры пренатальной диагностики активности BTD в культивируемых клетках амниотической жидкости и неонатального скрининга с использованием образцов крови. Активность BTD измеряют путем количественного определения высвобождения п -аминобензойной кислоты из N -биотинил- п -аминобензоата. Средняя (±SD) нормальная активность BTD составляет 5,8 ± 0,9 нмоль p-аминобензоат высвобождается в минуту на миллилитр сыворотки.
Общая частота глубокой и частичной недостаточности составляет 1 случай на 60 089 живорождений; по оценкам, 1 из 123 человек является гетерозиготным по этому заболеванию. Мутации гена BTD хорошо охарактеризованы на молекулярном уровне. Детей с глубоким дефицитом БТД лечат 5–20 мг биотина в день. При раннем выявлении состояние пациентов с симптомами быстро улучшается после начала терапии биотином; терапию необходимо продолжать на протяжении всей жизни.
8.2. Дефицит карбоксилаз и HCS
Пораженные лица имеют либо изолированный дефицит отдельных карбоксилаз, либо множественный дефицит биотин-зависимых карбоксилаз из-за дефекта HCS. Для пациентов с множественным дефицитом карбоксилаз характерна низкая активность всех пяти биотинзависимых карбоксилаз. Мутации гена HCS хорошо охарактеризованы на молекулярном уровне. Было подсчитано, что частота дефицита ГХС составляет менее 1 случая на 1000 живорождений в Японии. Пораженные люди обычно хорошо реагируют на введение фармакологических доз биотина, в частности, если мутация гена находится в биотин-связывающей области белка. Сообщалось лишь о нескольких случаях изолированной недостаточности карбоксилазы.
8.3. Дефицит переносчика биотина
Недавно был выявлен случай врожденного дефицита переносчика биотина. У больного были типичные признаки дефицита биотина, несмотря на нормальное потребление биотина; скорость транспорта биотина в лимфоидных тканях была значительно ниже по сравнению со здоровым контролем. Клинические признаки сходны с таковыми, описанными при множественном дефиците карбоксилазы и дефиците BTD.
9. Взаимодействие биотина с лекарственными средствами
9.1. Противосудорожные препараты
Потребность в биотине может повышаться во время противосудорожной терапии. Противосудорожные препараты примидон и карбамазепин ингибируют поглощение биотина мембранными везикулами щеточной каемки из кишечника человека. Длительная терапия противосудорожными препаратами увеличивает как катаболизм биотина, так и экскрецию 3-гидроксиизовалериановой кислоты с мочой. Фенобарбитал, фенитоин и карбамазепин вытесняют биотин из BTD, предположительно влияя на транспорт плазмы, почечную обработку или клеточное поглощение биотина.
9.2. Липоевая кислота
Липоевая кислота конкурирует с биотином за связывание с SMVT, потенциально снижая поглощение биотина клетками. Действительно, хроническое введение фармакологических доз липоевой кислоты снижало активность пируваткарбоксилазы и β-метилкротонил-КоА-карбоксилазы в печени крыс до 64–72% от контроля.
10. Требования и рекомендуемые дозы
10.1. Адекватное потребление
Совет по пищевым продуктам и питанию Национального исследовательского совета выпустил рекомендации по адекватному потреблению биотина в диапазоне от 5 мкг/день для новорожденных до 35 мкг/день для кормящих женщин (21–143 нмоль/день). Эти рекомендации основаны на предполагаемом потреблении биотина (не путать с «потребностями» и «рекомендованными диетическими нормами») в группе здоровых людей. Адекватное потребление устанавливается, когда потребность в определенном питательном веществе неизвестна; они могут служить целями для потребления питательных веществ людьми. Добавки биотина могут существенно способствовать потреблению биотина. Например, 15–20% людей в США сообщают о потреблении пищевых добавок, содержащих биотин.
10.2. Факторы, влияющие на потребность в биотине
Беременность может быть связана с повышенной потребностью в биотине. Недавние исследования предоставили доказательства предельного дефицита биотина во время беременности у человека, судя по повышенной экскреции 3-гидроксиизовалериановой кислоты с мочой. Беременность и курение ускоряют катаболизм биотина у женщин.
Лактация может вызвать повышенный спрос на биотин. Через 8 дней после родов биотин в грудном молоке составлял ~8 нмоль/л и составлял 44% от общего количества авидин-связывающих веществ; биснорбиотин и биотин- d,l -сульфоксиды составляли 48% и 8% соответственно. К 6 неделям после родов концентрация биотина увеличилась до ~30 нмоль/л и составила около 70% от общего количества авидин-связывающих веществ; биснорбиотин и биотин- d,l -сульфоксиды составляли около 20% и менее 10% соответственно.
11. Потребление и источники пищи
Большая часть биотина в мясе и злаках связана с белком. Большинство исследований содержания биотина в пищевых продуктах зависело от использования биотестов. Биотин широко распространен в натуральных пищевых продуктах. Продукты, относительно богатые биотином, включают яичный желток, печень и некоторые овощи. Потребление биотина с пищей у жителей Запада составляет около 35–70 мкг/сутки (143–287 нмоль/сутки). Младенцы, потребляющие 800 мл зрелого грудного молока в день, потребляют около 6 мкг (24 нмоль) биотина. Остается неясным, влияет ли синтез биотина кишечными микроорганизмами на общее поглощение биотина.
12. Избыток и токсичность
Эмпирически прием фармакологических доз биотина считается безопасным. Например, пожизненное лечение пациентов с дефицитом BTD дозами биотина, которые превышают нормальное потребление с пищей в 300 раз, не вызывает явных признаков токсичности. Точно так же не было зарегистрировано никаких признаков передозировки биотина после острого перорального и внутривенного введения доз, которые превышали потребление биотина с пищей до 600 раз. Добавки биотина влияют на экспрессию многочисленных генов. Неизвестно, являются ли какие-либо из этих изменений нежелательными.